
分析 金属铁在潮湿的空气下发生吸氧腐蚀,铁做负极发生氧化反应生成二价铁离子,碳等杂志做负极,氧气在负极得到电子发生还原生成氢氧根离子,根据原电池原理来书写电极反应和总反应,氢氧化亚铁具有强的还原性,被氧化生成氢氧化铁,氢氧化铁分解生成氧化铁,据此解答;
解答 解:金属铁在潮湿的空气下发生吸氧腐蚀,铁做负极发生氧化反应生成二价铁离子,电极反应式:2Fe-4e-=2Fe2+;碳等杂志做负极,氧气在负极得到电子发生还原生成氢氧根离子,电极反应式为:O2+4e-+2H2O=4OH-;原电池总反应方程式为:Fe2++2OH-=Fe(OH)2;氢氧化亚铁具有强的还原性,被氧化生成氢氧化铁,化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;氢氧化铁分解生成氧化铁,方程式为2Fe(OH)3=Fe2O3+3H2O.
故答案为:2Fe-4e-=2Fe2+;O2+4e-+2H2O=4OH-;①Fe2++2OH-=Fe(OH) 2;②4Fe(OH)2+O2+2H2O=4Fe(OH)3;③2Fe(OH)3=Fe2O3+3H2O.
点评 本题考查了金属的腐蚀与防护,题目难度不大,明确原电池工作原理,熟悉吸氧腐蚀和析氢腐蚀的区别是解题关键,题目难度不大.


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:解答题
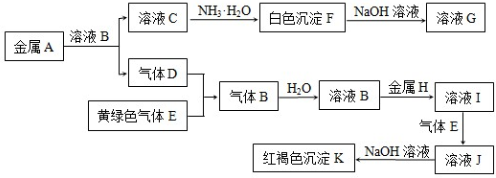
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
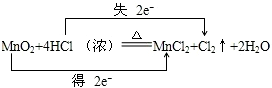
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 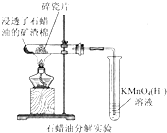 探究石蜡油分解的产物中含有不饱和烃 | |
| B. | 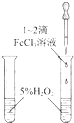 探究催化剂对化学反应速率的影响 | |
| C. |  验证酸性:CH3COOH>H2CO3>H2SiO3 | |
| D. | 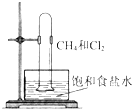 验证甲烷和氯气能发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 小苏打可用于治疗胃酸过多 | B. | Cl2可与石灰乳反应制取漂白粉 | ||
| C. | 用苯可萃取溴水中的溴 | D. | 高纯硅用来制造光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al$→_{△}^{O_{2}}$Al2O3 $\stackrel{HNO_{3}}{→}$Al(NO3)3$→_{△}^{蒸干}$Al(NO3)3晶体 | |
| B. | Cu$→_{△}^{O_{2}}$CuO$\stackrel{稀H_{2}SO_{4}}{→}$CuSO4溶液$\stackrel{蒸发、结晶}{→}$CuSO4•5H2O | |
| C. | Fe$→_{点燃}^{Cl_{2}}$FeCl3$\stackrel{过量氨水}{→}$Fe(OH)3$\stackrel{灼烧}{→}$Fe2O3 | |
| D. | NaOH溶液$\stackrel{SO_{2}}{→}$Na2SO3$\stackrel{SO_{2}}{→}$NaHSO3$→_{灼烧}^{蒸干}$Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 图标 | 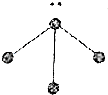 | 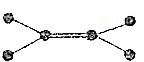 | 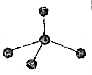 |  |
| 化学式 | NH3 | C2H4 | CCl4 | CO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com