
【题目】实验测定H2C2O4·xH2O 中x值: 已知:M(H2C2O4)=90 g·mol-1
①称取 1.260 g H2C2O4·xH2O晶体,将其配成100.00 mL 水溶液为待测液;
②量取 25.00mL 待测液放入锥形瓶中,再加入适量的稀H2SO4;
③用20.00ml浓度为 0.05000 mol·L-1的 KMnO4标准溶液进行滴定。
(提示:H2C2O4被氧化为CO2 , KMnO4被还原为MnSO4)
(1)请写出与滴定有关反应的化学方程式______________。
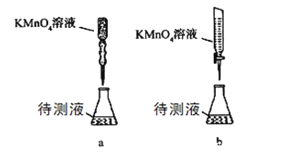
(2)某学生的滴定方式(夹持部分略去)如下,最合理的是_____(选填 a、b)。
(3)滴定过程中眼睛应注视______________________。
(4)通过上述数据,求得x=____________。以标准KMnO4溶液滴定样品溶液的浓度,未用标准KMnO4溶液润洗滴定管,引起实验结果______(偏大、偏小或没有影响)。
【答案】5H2C2O4+2KMnO4+3H2SO4=10CO2↑+2MnSO4+8H2O+K2SO4 b 锥形瓶中颜色变化 2 偏小
【解析】
根据氧化还原反应原理5H2C2O4+2KMnO4+3H2SO4=10CO2↑+2MnSO4+8H2O+K2SO4进行分析判断。根据高锰酸钾溶液具有强氧化性选择酸式滴定管;根据滴定主意事项进行判断。
(1)高锰酸钾把草酸氧化为二氧化碳,自身被还原为硫酸锰,根据电子得失守恒和原子守恒可知发生反应的化学方程式为5H2C2O4+2KMnO4+3H2SO4=10CO2↑+2MnSO4+8H2O+K2SO4;
(2)酸性高锰酸钾溶液具有强氧化性,不能用碱式滴定管盛放,只能选择酸式滴定管盛放,故选b装置;
(3)滴定过程中眼睛应注视锥形瓶中颜色变化,当滴最后一滴KMnO4,溶液由无色变为紫红色,且半分钟不褪色,说明达到滴定终点;答案:锥形瓶中颜色变化。
(4)由5H2C2O4+2KMnO4+3H2SO4=10CO2↑+2MnSO4+8H2O+K2SO4知5H2C2O4~2KMnO4,c(H2C2O4)=(20.00mL×0.05000 mol·L-1×5)/2×25mL=0.1 mol·L-1,n(H2C2O4)=0.1 mol·L-1×0.1L=0.01mol,所以n(H2O)=(1.260g-0.01mol×90 g·mol-1)/18 g·mol-1=0.02mol。0.01mol H2C2O4中含有0.02molH2O,所以x=2;以标准KMnO4溶液滴定样品溶液的浓度,未用标准KMnO4溶液润洗滴定管,导致KMnO4溶液浓度较低,消耗标准KMnO4溶液的体积偏大,引起实验结果偏小。


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案科目:高中化学 来源: 题型:
【题目】设Na为阿伏加德罗常数的值。已知反应:
①CH4 (g) +2O2 (g) = CO2 (g) +2H2O(l) △H1 =a kJ mol -1
②CH4(g) + 2O2 (g) = CO2 (g) +2H2O(g) △H2 =bkJ mol-1
键能定义:在标准状况下,将1 mol气态分子AB(g)解离为气态原子
A(g)、B(g)所需的能量。已知1 mol氧气的键能为xkJ。其他数据如下 表所示,下列说法正确的是
化学键 | C—O | C—H | O—H |
键能/(kJ mol-1) | 798 | 413 | 463 |
A.上文中x=![]()
B.H2O(g) = H2O(1)的△S<0、△H=(a — b) kJ mol -1
C.当有4NA个O—H键生成时,反应放出的热量为a kJ
D.利用反应①设计的原电池电解精炼铜,当负极输出0.2NA个电子时. 理论上电解槽的阴极质量增重6.4 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)乙烯使溴水褪色的反应类型和使酸性高锰酸钾溶液褪色的反应类型____(填“相同”或“不相同”)。
(2)用苯制备溴苯的化学方程式是____,该反应的类型___。
(3)已知2CH3CHO+O2![]() 2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如图所示。
2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如图所示。
![]()
则反应②的化学方程式为___,该反应的类型为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸(H3PO4)在溶液中能够以H3PO4、H2PO4-、HPO42-、和PO43-四种粒子形式存在,当溶液的pH发生变化时,其中任一种粒子的物质的量占四种粒子总物质的量的分数δ也可能发生变化。下图是H3PO4溶液中,各种粒子的物质的量分数δ随pH的变化曲线:
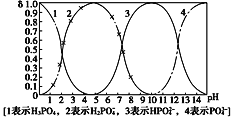
(1)向Na3PO4溶液中逐滴滴入稀盐酸,当pH从9降到6的过程中发生的主要反应的离子方程式为________。当pH=7时,溶液中主要存在的阴离子(OH-离子除外)是__________。
(2)从图中推断NaH2PO4溶液呈______性(填“酸”“碱”或“中”),其原因是_________。
(3)在Na3PO4溶液中,c(Na+)/c(PO43-)______3(填“>”“=”或“<”);向该溶液中滴入几滴浓KOH溶液后,c(Na+)/c(PO43-)的值减小,原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学结合所学知识探究Na2O2与H2能否反应,设计装置如下,下列说法正确的是

A. 装置A气密性的检查方法:直接向长颈漏斗中加水,当漏斗中液面高于试管中液面且高度不变说明气密性良好
B. 装置B中盛放硅胶,目的是除去A中挥发出来的少量水蒸气
C. 装置C加热前,用试管在干燥管管口处收集气体点燃,通过声音判断气体纯度
D. 装置A也可直接用于Cu与浓硫酸反应制取SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述正确的是( )
A.已知C(石墨,s)![]() C(金刚石,s) △H>0,则金刚石比石墨稳定
C(金刚石,s) △H>0,则金刚石比石墨稳定
B.含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则该反应的热化学方程式为:NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=-57.4kJ/mol
C.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
D.N2(g)+3H2(g)![]() 2NH3(g);△H=-akJ·mol-1,则将14gN2(g)和足量H2置于一密闭容器中,充分反应后放出0.5akJ的热量
2NH3(g);△H=-akJ·mol-1,则将14gN2(g)和足量H2置于一密闭容器中,充分反应后放出0.5akJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,向10 mL浓度为0.01mol/L的氨水溶液中逐滴加入0.01mol/L的CH3COOH溶液,混合液的pH 与加入CH3COOH 的体积V之间的变化曲线如下图所示。下列说法正确的是
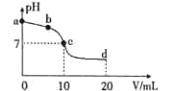
A. a点溶液的pH=12
B. b点时c(CH3COO-)>c(NH4+)
C. c点时水的电离程度最大
D. d点处微粒间存在:2c(H+)+c(CH3COO-)=2c(OH-)+c(NH3·H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、铜及其化合物在日常生产、生活有着广泛的应用。请回答下列问题:
(1)铁在元素周期表中的位置是________________。
(2)配合物Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于___________(填晶体类型)。Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=_______;Fe(CO)x在一定条件下发生反应:Fe(CO)x(s)![]() Fe(s)+xCO(g)。已知反应过程中只断裂配位键,由此判断该反应所形成的化学键类型为_________。
Fe(s)+xCO(g)。已知反应过程中只断裂配位键,由此判断该反应所形成的化学键类型为_________。
(3)写出CO的一种常见等电子体分子的结构式____________;两者相比较沸点较高的为__________(填化学式)。CN-中碳原子杂化轨道类型为__________,C、N、O三元素的第一电离能最大的为_______(用元素符号表示)。
(4)铜与Cl形成化合物的晶胞如图所示(黑点代表铜原子)。
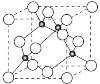
①该晶体的化学式为________。它可与浓盐酸发生非氧化还原反应,生成配合物H2CuCl3,反应的化学方程式为___________________。
②已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于______(填“离子”、“共价”)化合物。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com