
处于同一周期的A、B、C、D四种短周期元素,其气态原子获得一个电子所放出的能量A>B>C>D。则下列关于A、B、C、D四种元素的说法中,正确的是
A.元素的非金属性依次增强 B.元素的电负性依次减小
C.元素的第一电离能依次增大 D.最高价氧化物对应水化物的酸性依次减弱
BD
【解析】
试题分析:同周期元素气态原子获得一个电子所放出的能量A>B>C>D,说明金属性A<B<C<D,同周期元素从左到右元素的金属性逐渐降低,则原子序数A>B>C>D,则A、同周期元素原子序数A>B>C>D,元素的非金属性依次减弱,故A错误;B、同周期元素原子序数A>B>C>D,同周期元素从左到右元素的电负性依次减小,故B正确;C、由气态原子获得一个电子所放出的能量A>B>C>D可知由元素的第一电离能依次减小,故C错误;D、同周期元素原子序数A>B>C>D,同周期元素从左到右元素非金属性逐渐增强,对应最高价氧化物对应水化物的酸性依次增强,则A、B、C、D最高价氧化物对应水化物的酸性依次减弱,故D正确,答案选BD。
考点:考查元素周期表和元素周期律的应用


科目:高中化学 来源:2013-2014江苏省泰州市姜堰区高二下学期期中考试 化学试卷(解析版) 题型:实验题
(12分)某化学兴趣小组用如下图1所示装置进行探究实验,以验证产物中有乙烯生成且乙烯具有不饱和性。当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色。
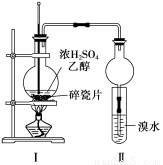

图1 图2
(1)写出该实验中生成乙烯的化学方程式 。
(2)甲同学认为:考虑到该混合液体反应的复杂性,溴水褪色的现象不能证明反应中有乙烯生成且乙烯具有不饱和性,其理由正确的是 。
a.乙烯与溴水易发生取代反应
b.使溴水褪色的反应,未必是加成反应
c.使溴水褪色的物质,未必是乙烯
(3)乙同学经过细致观察后试管中另一现象后并借用pH试纸测定,证明反应中有乙烯生成,请简述
。
(4)丙同学对上述实验装置进行了改进,在Ⅰ和Ⅱ之间增加上图2装置以除去乙醇蒸气和SO2,则A中的试剂是 ,B中的试剂为 。
(5)处理上述实验后烧瓶中废液的正确方法是 。
a.冷却后倒入下水道中 b.冷却后倒入空废液缸中 c.冷却后加水稀释,倒入废液缸中,加废碱中和
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省无锡市高一下学期期末考试化学试卷(解析版) 题型:选择题
下列化学用语对应正确的是
A.CH4分子的比例模型: B.CCl4的电子式:
B.CCl4的电子式:
C.H2O2的结构式:H-O-O-H D.乙酸的最简式:C2H4O2
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高一期末模拟化学试卷(解析版) 题型:选择题
简单原子的原子结构可用下图形象地表示,其中?表示质子,○表示中子:①; ②
② ;③
;③ 。则下列有关这三种原子的叙述中正确的是
。则下列有关这三种原子的叙述中正确的是
A.属于不同的元素 B.具有相同的质量数 C.具有不同的核电荷数 D.化学性质相似
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高二下学期阶段测试5月 化学试卷(解析版) 题型:填空题
(10分)在研究原子核外电子排布与元素周期表的关系时,人们发现外围电子排布相似的元素集中在一起。据此,人们将元素周期表重新分为五个区。在1-36号元素中
(1)在s区中,族序数最大的元素,其原子的价电子的电子云形状为 。
(2)在d区中,人类使用最早,应用最广泛的元素的常见离子的电子排布式为 , 。
(3)在ds区中,原子序数最大的元素,原子的价电子排布式为 。
(4)在p区中,第2周期、ⅤA族元素原子价电子的轨道表示式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高二下学期阶段测试5月 化学试卷(解析版) 题型:选择题
下列有关实验装置进行的相应实验,能达到实验目的的是
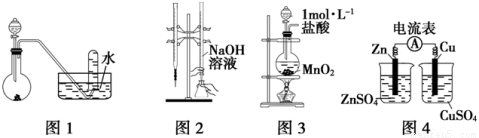
A.用图1所示装置进行稀硝酸与铜的反应制取并收集NO
B.用图2所示装置进行用已知浓度的氢氧化钠溶液测定盐酸浓度的实验
C.用图3所示装置制取少量Cl2
D.用图4所示装置检验电流的方向
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高三模拟考试化学试卷(解析版) 题型:填空题
铜及其化合物在工农业生产及日常生活中应用非常广泛。
(1)由辉铜矿制取铜的反应过程为:
2Cu2S(s) + 3O2 (g) = 2Cu2O(s) + 2SO2(g) △H=-768.2kJ·mol-1, ①
2Cu2O(s) + Cu2S(s) = 6Cu(s) + SO2(g) △H=+116.0kJ·mol-1, ②
①热化学方程式:Cu2S(s) + O2(g) = 2Cu(s) + SO2(g) △H= kJ·mol-1。
②获得的粗铜需电解精炼,精炼时粗铜作 极(选填:“阳”或“阴”)。
(2)氢化亚铜是一种红色固体,可由下列反应制备
4CuSO4 + 3H3PO2 + 6H2O = 4CuH↓ + 4H2SO4 + 3H3PO4 。
①该反应还原剂是 (写化学式)。
②该反应每转移3 mol电子,生成CuH的物质的量为 。
(3)氯化铜溶液中铜各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与c(Cl-) 的关系如图。

①当c(Cl-)=9 mol·L-1时,溶液中主要的3种含铜物种浓度大小关系为 。
②在c(Cl-)=1 mol·L-1的氯化铜溶液中,滴入AgNO3溶液,含铜物种间转化的离子方程式为 (任写一个)。
(4) 电解Na2HPO3溶液可得到亚磷酸,装置如图(说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过)
①阳极的电极反应式为____________________。
②产品室中反应的离子方程式为____________。
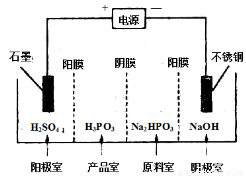
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高三模拟考试化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.1.0 mol/L的NaHSO4溶液:K+、Fe2+、NO3-、Cl-
B.l.0 mol·L-1 NaClO溶液:Fe2+、K+、I一、Cl-
C.甲基橙显黄色的溶液: Na+、CO32-、NO3-、SO32-
D.在c(H+)/c(OH-) = 1×1013的溶液:NH4+、Ca2+、C1-、K+
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省徐州市高三第三次模拟考试化学试卷(解析版) 题型:选择题
用下列装置进行相应实验,不能达到实验目的的是( )

A. 图1所示装置可制备氢氧化亚铁
B. 图2所示装置可电解食盐水制氯气和氢气
C. 图3所示装置可验证氨气极易溶于水
D. 图4所示装置与操作可除去苯中的苯酚
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com