
【题目】下列化学用语正确的是
A.(NH4)2 Fe(SO4)2 溶解于水:(NH4)2 Fe(SO4)2 ![]() 2NH4+ + Fe2 + + 2SO42-
2NH4+ + Fe2 + + 2SO42-
B.Al(OH)3在水中的电离:H+ + H2O+ AlO2-![]() Al(OH)3
Al(OH)3 ![]() Al3 ++3OH-
Al3 ++3OH-
C.H3PO4溶解于水:H3PO4 ![]() 3H+ + PO43-
3H+ + PO43-
D.NaHSO3在水中的电离:HSO3- + H2O ![]() SO32-+ H3O+
SO32-+ H3O+
【答案】B
【解析】
A. (NH4)2 Fe(SO4)2 为强电解质,溶解于水时完全电离:(NH4)2 Fe(SO4)2 =2NH4+ + Fe2 + + 2SO42-,与题意不符,A错误;
B. Al(OH)3为两性氢氧化物,在水中可发生酸式电离或碱式电离:H++ H2O+AlO2-![]() Al(OH)3
Al(OH)3![]() Al3++3OH-,符合题意,B正确;
Al3++3OH-,符合题意,B正确;
C. H3PO4为弱电解质,溶解于水发生分步电离:H3PO4![]() H++H2PO4-,H2PO4-
H++H2PO4-,H2PO4-![]() H++HPO42-,HPO42-
H++HPO42-,HPO42-![]() H++PO43-,与题意不符,C错误;
H++PO43-,与题意不符,C错误;
D. NaHSO3为强电解质,在水中的电离:NaHSO3=HSO3-+Na+,与题意不符,D错误;
答案为B。


科目:高中化学 来源: 题型:
【题目】化学反应2A(g)+B(?)![]() 2C(g)达到化学平衡时:
2C(g)达到化学平衡时:
(1)升高温度时,C的量减少,则反应物的能量总和_____生成物的能量总和(填“>”、“<”或“=”)。
(2)如果增大压强,平衡向正反应方向移动,则B是_______态物质。
(3)若增加B的物质的量,平衡不移动,说明B是____________态物质。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法中,不正确的是

A. 正极电极反应式为:2H++2e—→H2↑
B. 此过程中还涉及到反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3
C. 此过程中铜并不被腐蚀
D. 此过程中电子从Fe移向Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A的结构简式为![]() ,它可通过不同化学反应分别制得B、C、D和E四种物质。
,它可通过不同化学反应分别制得B、C、D和E四种物质。
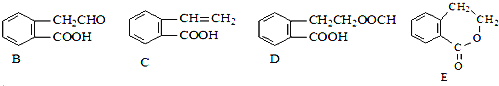
请回答下列问题:
![]() 在
在![]() 五种物质中,互为同分异构体的是______
五种物质中,互为同分异构体的是______![]() 填代号
填代号![]() 。
。
![]() 写出下列反应的反应类型
写出下列反应的反应类型![]() :______,
:______,![]() :______,
:______,![]() :______,
:______,![]() :______。
:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施或事实不能用勒夏特列原理解释的是
A.新制的氯水在光照下颜色变浅
B.NO2和N2O4平衡混合气缩小体积加压后颜色先变深后变浅一点
C.高锰酸钾溶液与草酸发生化学反应刚开始缓慢,随后反应迅速加快
D.硫酸工业上SO2氧化成SO3,通入过量的空气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积可变的密闭容器中充入2 mol A和1 mol B发生反应:mA(g) + nB(g) ![]() pC(g)。在一定温度下达到平衡时,分别得到A的物质的量浓度如下表,以下说法正确的是
pC(g)。在一定温度下达到平衡时,分别得到A的物质的量浓度如下表,以下说法正确的是
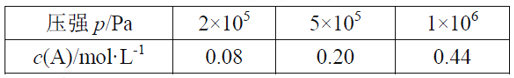
A. 维持压强2×105Pa,若反应开始后5min时达到平衡,则v(A)=0.016mol/(L·min)
B. P从2×105Pa增加到5×105Pa时,平衡逆向移动
C. P为1×106Pa时,平衡常数表达式K=![]()
D. 其它条件相同时,在上述三个压强下分别发生该反应。A的转化率随时间变化曲线如图所示
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】节能和减排建设友好型社会的必然选择。回答下列问题:
(1)已知在一定温度下,①C(s)+CO2(g) ![]() 2CO(g) ΔH1=a kJ·mol-1 平衡常数K1;
2CO(g) ΔH1=a kJ·mol-1 平衡常数K1;
②CO(g)+H2O(g) ![]() H2(g)+CO2(g) ΔH2=b kJ·mol-1 平衡常数K2。
H2(g)+CO2(g) ΔH2=b kJ·mol-1 平衡常数K2。
某反应的平衡常数表达式K3= ![]() ,请写出此反应的热化学方程式______________,K1、K2、K3之间的关系是_____________。
,请写出此反应的热化学方程式______________,K1、K2、K3之间的关系是_____________。
(2)将原料气按n(CO2)∶n(H2)=1∶4置于密闭容器中发生CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)反应,测得H2O(g)的物质的量分数与温度的关系如下图所示:
CH4(g)+2H2O(g)反应,测得H2O(g)的物质的量分数与温度的关系如下图所示:
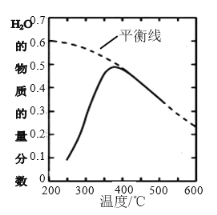
①该反应的平衡常数K随温度降低而________(填“增大”或“减小”)。
②在密闭恒温(高于100℃)恒容装置中进行该反应,达到平衡状态的是________。
a.混合气体密度不再改变 b.混合气体压强不再改变
c.混合气体平均摩尔质量不再改变 d.n(CO2)∶n(H2)=1:2
③200℃达到平衡时体系的总压强为P,该反应平衡常数Kp的计算表达式为______(不必化简,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)500℃时,CO与水反应生成CO2和H2,将其分离得到H2的过程示意图如下:

①阳极反应式是_______________________________________________。
②结合电极反应式,简述K2CO3溶液的再生原理___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨氮废水超标排放是水体富营养化的重要原因,可用以下流程处理:

下列说法正确的是
A.过程I中发生的化学反应属于氧化还原反应
B.过程Ⅱ中![]() ,每转化
,每转化![]() 转移的电子数为6NA
转移的电子数为6NA
C.过程Ⅲ中CH3OH→CO2,甲醇作还原剂
D.过程Ⅲ中HNO3→N2,转移10mol e-时可生成N2 11.2L(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期的A、B、C、D、E五种元素,原子序数逐渐增大。A元素核外有三个电子层,最外层电子数是核外电子总数的1/6;B元素核外只有一个未成对电子,能与水剧烈反应;C元素正三价离子的3d轨道为半充满状态;D元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;E元素的价电子构型为nsanpa+1,其某种氧化物有剧毒。
(1)A元素的第一电离能___Al元素的第一电离能(填“<”“>”或“=”),请解释原因___。
(2)写出B2O2与H2O反应过程中断裂的化学键的种类___。
(3)C元素位于元素周期表的___区,它的价电子排布式是___,C(CO)x的中心原子价电子数与配位数提供的电子数之和为18,则x=___。
(4)D2O的熔点比D2S的熔点高,其原因是___。
(5)ECl3分子的立体构型为___,其中E的杂化类型为___,E元素可能的性质为___(从下列选项中选择)。
A.其单质可作为半导体材料
B.其电负性大于磷
C.最高价氧化物对应的水化物是强酸
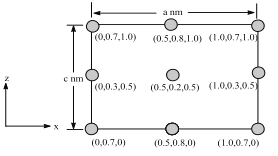
(6)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。BSiAl3O7属于正交晶系(长方体形),晶胞参数为anm、bnm、cnm。如图为沿y轴投影的晶胞中所有B原子的分布图和原子分数坐标。据此推断该晶胞中B原子数目为___;BSiAl3O7的摩尔质量为Mgmol-1,设NA为阿伏伽德罗常数的值,则晶体的密度=___(gcm3)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com