
| A. | NH3是极性分子,分子中N原子处在3个H原子所组成的三角形的中心 | |
| B. | CH2Cl2是非极性分子,分子中C原子处在H、Cl原子所组成的四边形的中心 | |
| C. | H2O是极性分子.分子中O原子不处在2个H原子所连成的直线的中央 | |
| D. | CO2中的C=O键是极性键,所以CO2是极性分子 |
分析 A.根据中心原子形成的δ键数以及孤对电子数目判断分子的立体构型;
B.根据甲烷的空间构型来判断,CH2Cl2分子的空间构型分子结构对称电荷中心重叠的分子为非极性分子;
C.正负电荷重心不重合的是极性分子,根据价层电子对互斥理论确定微粒空间构型和中心原子杂化方式的判断分子中O原子不处在2个H原子所连成的直线的中央;
D.一般来说,活泼金属与非金属形成离子键,同种非金属之间形成非极性共价键,不同非金属元素之间形成极性共价键,正负电荷重心不重合的是极性分子.
解答 解:A.N与3个H原子形成δ键,孤对电子数为$\frac{5-3}{2}$=1,所以N原子采用sp3杂化,为三角锥形分子,不是三角形,故A错误;
B.甲烷中4个共价键完全相同为正四面体,CH2Cl2分子位2个Cl原子取代甲烷中2个H所得,为四面体,不是四边形,CH2Cl2分子不结构对称,电荷中心不重叠,为极性分子,故B错误;
C.H2O中O与2个H形成δ键,孤对电子数为$\frac{6-2}{2}$=2,所以O原子采用sp3杂化,为V形分子,分子中O原子和2个H原子不在一条直线上,分子中O原子不处在2个H原子所连成的直线的中央,该分子正负电荷重心不重合,为极性分子,故C正确;
D.CO2中C-O键是不同元素形成的共价键,为极性键,CO2中C与2个O形成δ键,孤对电子数为$\frac{4-2×2}{2}$=0,所以C原子采用sp杂化,为直线形分子,分子中C原子和2个O原子在一条直线上,该分子正负电荷重心重合,为非极性分子,故D错误;
故选C.
点评 本题考查了分子的极性判断,根据价层电子对互斥理论及正负电荷重心是否重合来分析解答即可,注意把握δ键数以及孤对电子数目判断,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 甲烷的结构式:CH4 | |
| B. | 硫离子的结构示意图: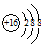 | |
| C. | Na2S的电子式: | |
| D. | 硫酸钠电离方程式:Na2SO4=Na2++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
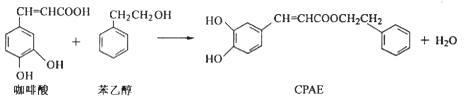
| A. | 苯乙醇属于芳香醇,它与邻甲基苯酚互为同系物 | |
| B. | 用FeCl3溶液可以检测上述反应中是否有CPAE生成 | |
| C. | 1 mol CPAE最多可与含3 molNaOH的溶液发生反应 | |
| D. | 咖啡酸、苯乙醇及CPAE都能发生取代、加成和消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在元素周期表金属与非金属的分界处可以寻找催化剂和耐高温、耐腐蚀的合金材料 | |
| B. | 两种微粒,若核外电子排布完全相同,则其化学性质一定相同 | |
| C. | 水分子很稳定,是因为水中存在氢键 | |
| D. | 在多电子的原子里,能量高的电子通常在离核远的区域内活动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的密度不再变化 | B. | 反应容器中Y的质量分数不变 | ||
| C. | 体系压强不再变化 | D. | Z的浓度不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 白磷、熟石灰、生石灰 | B. | 氮气、空气、胆矾 | ||
| C. | 铁、氯化氢、干冰 | D. | 液态氧、烧碱、碘酒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Mg2+、Al3+、CO32- | B. | Na+、K+、Cl-、Ba2+ | ||
| C. | H+、Fe3+、Cl-、SCN- | D. | OH-、Ba2+、Cl-、NO${\;}_{3}^{-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com