
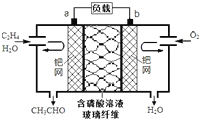
 乙烯催化氧化成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2=CH2+O2→2CH3CHO.下列有关说法正确的是( )
乙烯催化氧化成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2=CH2+O2→2CH3CHO.下列有关说法正确的是( )| A、该电池为可充电电池 |
| B、电子移动方向:电极a→磷酸溶液→电极b |
| C、正极反应式为:CH2=CH2-2e-+2OH-→CH3CHO+H2O |
| D、每有0.1mol O2反应,则迁移H+0.4mol |


科目:高中化学 来源: 题型:
| A、1 mol甲与足量的乙完全反应共转移了1 mol电子 |
| B、Y元素在周期表中的位置为第三周期第ⅣA族 |
| C、原子半径:W>Z>Y>X |
| D、1.0 L 0.1 mol?L-1戊溶液中阴离子总的物质的量小于0.1 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某化学研究小组探究溴化亚铁水溶液与氯气反应.
某化学研究小组探究溴化亚铁水溶液与氯气反应.| 试验 | 操作 | 现象 |
| a | 取少量FeCl2溶液于试管中,滴加少量氯,再滴加2滴KSCN溶液,振荡静置. | 溶液变为血红色 |
| b | 取少量FeCl3溶液于试管中,滴加少量溴化钠溶液和少量CCl4,振荡静置. | CCl4层没有明显变化 |
| c | |
CCl4层由无色变为橙红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、通过1H核磁共振谱图可以区分乙醇和乙酸乙酯 |
| B、常温常压下,5.6g乙烯与丁烯的混合物中含有共用电子对数目为1.2NA(设NA为阿伏加德罗常数的值.) |
| C、在50g质量分数为56%的乙醇水溶液中,含有氢原子总数为3NA(设NA为阿伏加德罗常数的值.) |
| D、煤干馏主要得到焦炭、煤焦油、粗氨水和焦炉气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
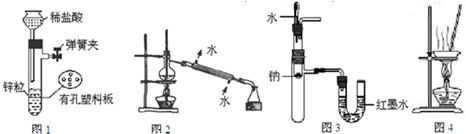
| A、用图1所示装置制取少量H2 |
| B、用图2所示装置分离Na2CO3溶液和CH3COOC2H5的混合物 |
| C、用图3所示装置验证Na和水反应的热效应 |
| D、用图4所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在1L 0.1mol/L的醋酸溶液中所含分子数目小于0.1NA |
| B、质量相同的N2和CO中,含有的电子数均为14NA |
| C、标准状况下,11.2L氮气和22.4L氢气在一定条件下充分反应,原子数目小于3NA |
| D、在V L 0.1mol/L的氯化铁溶液中,若Fe3+的数目为NA,Cl-的数目大于3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、误食重金属盐引起人体中毒,可喝大量的食盐水解毒 |
| B、变质的油脂有难闻的特殊气味,是由于油脂发生了水解反应 |
| C、浸泡过高锰酸钾溶液的硅藻土放于水果箱内是为了延长水果保鲜期 |
| D、安装煤炭燃烧过程的“固硫”装置,主要是为了提高煤的利用率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol乙烯和乙醇的混合物完全燃烧所消耗的O2一定为0.3NA |
| B、常温常压下,46g NO2与N2O4的混合气体中含有的分子总数为NA |
| C、25℃时,pH=13的Ba(OH)2溶液中含有OH-的数目为0.1NA |
| D、一定量的钠与8g氧气作用,若两者均无剩余,转移NA个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com