
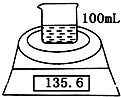
 如图是测定镁粉(含铝粉)的纯度的实验装置.所用的NaOH浓度为4.6mol?L-1.
如图是测定镁粉(含铝粉)的纯度的实验装置.所用的NaOH浓度为4.6mol?L-1.| 实验操作 | 时间/min | 电子天平的读数/g |
| 烧杯+NaOH溶液 | 120 | |
| 烧杯+NaOH溶液+样品 | 0 | 135.6 |
| 1 | 135.1 | |
| 2 | 134.7 | |
| 3 | 134.4 | |
| 4 | 134.4 |
| 54×1.2g |
| 6 |
| 4.8g |
| 15.6g |
| 1.2g |
| 2g/mol |
| 2×0.6mol |
| 3 |
| 0.4mol |
| 0.1L |


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:
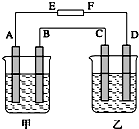 在如图中,甲烧杯中盛有100mL 0.50mol?L-1 AgNO3溶液,乙烧杯中盛有100mL 0.25mol?L-1CuCl2溶液,A、B、C、D均为质量相同的石墨电极,如果电解一段时间后,发现A极比C极重1.9g,则
在如图中,甲烧杯中盛有100mL 0.50mol?L-1 AgNO3溶液,乙烧杯中盛有100mL 0.25mol?L-1CuCl2溶液,A、B、C、D均为质量相同的石墨电极,如果电解一段时间后,发现A极比C极重1.9g,则查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 金属冶炼和处理常涉及氧化还原反应.
金属冶炼和处理常涉及氧化还原反应.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定含有SO42- |
| B、一定含有Ag+ |
| C、一定不含CO32- |
| D、可能含有SO42-或Ag+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、MnO2CuO FeO |
| B、Na2CO3CaCO3 K2CO3 |
| C、AgNO3KNO3 Na2CO3 |
| D、(NH4)2SO4 K2SO4 NH4Cl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com