
下列原子的价电子构型中,第一电离能最小的是( )
A.2s22p4 B.3s23p4
C.4s24p4 D.5s25p4
科目:高中化学 来源: 题型:
燃料电池是利用燃料(如CO、H2、CH4等)与氧气反应,将反应产生的化学能转变为电能的装置,通常用氢氧化钾作为电解质溶液。完成下列关于甲烷(CH4)燃料电池的填空:
(1)甲烷与氧气反应的化学方程式为:__________________。
(2)已知燃料电池的总反应式为CH4+2O2+2KOH===K2CO3+3H2O,电池中有一极的电极反应为CH4+10OH--8e-===CO +7H2O,这个电极是燃料电池的________(填“正极”或“负极”),另一个电极上的电极反应式为:___________________________。
+7H2O,这个电极是燃料电池的________(填“正极”或“负极”),另一个电极上的电极反应式为:___________________________。
(3)随着电池不断放电,电解质溶液的碱性________(填“增大”“减小”或“不变”)。
(4)通常情况下,甲烷燃料电池的能量利用率______(填“大于”“小于”或“等于”)甲烷燃烧的能量利用率。
查看答案和解析>>
科目:高中化学 来源: 题型:
现有部分短周期元素的性质或原子结构如下表:
| 元素编号 | 元素性质或原子结构 |
| T | M层上有2对成对电子 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
(1)元素T的原子最外层共有________种不同运动状态的电子。元素X的一种同位素可测定文物年代,这种同位素的符号是_______。
(2)元素Y与氢元素形成一种离子YH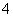 ,写出该微粒的电子式 ________(用元素符号表示)。
,写出该微粒的电子式 ________(用元素符号表示)。
(3)元素Z与元素T相比,非金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是________。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的最高价氧化物对应的水化物中化学性质明显不同于其他三种酸的是________,理由是:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
具有下列电子排布式的原子中,原子半径最大的是( )
A.1s22s22p62s23p2 B.1s22s22p63s2
C.1s22s22p2 D.1s22s22p63s23p4
查看答案和解析>>
科目:高中化学 来源: 题型:
下列给出14种元素的电负性:
| 元素 | Al | B | Be | C | Cl | F | Li | Mg | N | Na | O | P | S | Si |
| 电负性 | 1.5 | 2.0 | 1.5 | 2.5 | 3.0 | 4.0 | 1.0 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.8 |
请运用元素周期律知识完成下列各题。
(1)同一周期中,从左到右,元素的电负性逐渐________;同一主族中,从上到下,元素的电负性逐渐________。所以,元素的电负性随原子序数的递增呈________变化。
(2)短周期元素中,由电负性最大的元素与电负性最小的元素形成的化合物的化学式为________,用电子式表示该化合物的形成过程:____________________________________。
(3)表中符合“对角线规则”的元素有Li和________、Be和________、B和________,它们的性质分别有一定的相似性,其原因是____________________,写出Be(OH)2与强酸及强碱反应的离子方程式:____________________________________。
(4)一般认为,两成键元素间电负性差值大于1.7时形成离子键,两成键元素间电负性差值小于1.7时,形成共价键。判断Mg3N2、SO2、AlCl3、CS2、MgO是离子化合物还是共价化合物。
离子化合物___________________________________________
共价化合物___________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
从石油分馏得到的固体石蜡,用氯气漂白后燃烧时会产生含氯元素的气体,这是由于漂白时发生过( )
A.加成反应 B.取代反应
C.裂解反应 D.催化裂化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com