
| A. | 标准状况下,22.4L庚烷完全燃烧生成二氧化碳分子数为8NA | |
| B. | 28克由C3H6和C4H8组成的混合气体中含共用电子对数目为6NA个 | |
| C. | 0.1mol氧气作为氧化剂得到电子的数目一定为0.4NA | |
| D. | 常温下,0.1mol•L-1的碳酸钠溶液中含有的阴离子数大于0.1NA |
分析 A、标况下庚烷为液态;
B、C3H6和C4H8的最简式均为CH2;
C、氧气作为氧化剂后可能变为-2价,还可能变为-1价;
D、溶液体积不明确.
解答 解:A、标况下庚烷为液态,故不能根据气体摩尔体积来计算其物质的量,故A错误;
B、C3H6和C4H8的最简式均为CH2,故28g混合物中含有的CH2的物质的量为2mol,故含6NA对共用电子对,故B正确;
C、氧气作为氧化剂后可能变为-2价,还可能变为-1价,故0.1mol氧气反应后得到的电子数可能为0.4NA个,还可能为0.2NA个,故C错误;
D、溶液体积不明确,故溶液中的阴离子的个数无法计算,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
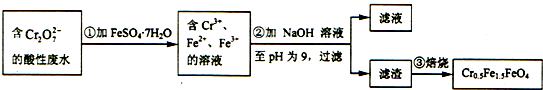
| A. | 根据第①步反应可知还原性:Cr3+大于Fe2+ | |
| B. | 第②步过滤得到的滤渣中主要成分为Cr(OH)3、Fe(OH)2,不含Fe(OH)3 | |
| C. | 欲使1L该废水中的Cr2O72-完全转化为Cr0.5Fe1.5FeO4,理论上需要加入27.8g FeSO4•7H2O | |
| D. | 第③步高温焙烧过程用到的主要实验仪器中属于硅酸盐质的有:酒精灯、蒸发皿、泥三角 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
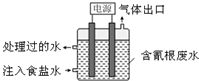 某些工业废水中常是含有氰根(CN-)的无机物,有一定的毒性,有的还是剧毒.图所示装置是工业上采用的电解法除去含CN-废水的装置.工作时控制溶液为碱性,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列叙述不正确的是( )
某些工业废水中常是含有氰根(CN-)的无机物,有一定的毒性,有的还是剧毒.图所示装置是工业上采用的电解法除去含CN-废水的装置.工作时控制溶液为碱性,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列叙述不正确的是( )| A. | 用石墨作阴极,铁作阳极 | |
| B. | 阴极的电极反应式为:2H2O+2e-=H2↑+2OH- | |
| C. | 阳极的电极反应式为:Cl-+2OH--2e-=ClO-+H2O | |
| D. | 除去CN-的反应:2CN-+5ClO-+H2O=N2↑+2CO2↑+5Cl-+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
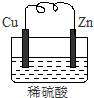 由铜片、锌片和200ml稀H2SO4组成的原电池中,一段时间后某极产生3.36L(标准状况)的气体.
由铜片、锌片和200ml稀H2SO4组成的原电池中,一段时间后某极产生3.36L(标准状况)的气体.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制一定物质的量浓度的溶液时,容量瓶必须洁净、干燥,不漏水 | |
| B. | 实验室里需要480 mL 2.0 mol/L的氢氧化钠溶液,配制该溶液时先称量氢氧化钠固体38.4 g,然后再按照溶解、冷却、移液、定容、摇匀的步骤进行操作 | |
| C. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液的浓度偏大 | |
| D. | 实验室配制500 mL 0.2 mol/L的硫酸亚铁溶液,其操作是用天平称量27.8 g绿矾,将其放入500 mL容量瓶,加水溶解、稀释、定容、摇匀 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 所有的物质中都含有化学键 | |
| B. | 含有非极性键的化合物不一定是共价化合物 | |
| C. | 反应物总能量低于生成物总能量的反应一定是吸热反应 | |
| D. | 由非金属元素构成的化合物一定是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇在浓硫酸存在的情况下与乙酸发生酯化反应 | |
| B. | 乙醇与金属钠反应 | |
| C. | 乙醇在浓硫酸作用下的消去反应 | |
| D. | 乙醇与O2的催化氧化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com