
| 步骤 | 操作 | 现象 |
| (1) | 向溶液中滴加稀盐酸 | 有刺激性气味气体产生 |
| (2) | 向溶液中滴加氯水,再加入CCl4振荡,静置 | CCl4层呈橙色 |
| (3) | 向(2)所得的水溶液中加入Ba(NO3)2和稀HNO3 | 有白色沉淀产生 |
| (4) | 过滤,向滤液中加入AgNO3溶液和稀HNO3 | 有白色沉淀产生 |
分析 (1)取少许溶液向其中滴加稀盐酸,有刺激性气味气体产生,说明含有⑤SO32-;
(2)另取少许溶液向其中滴加氯水,及CCl4振荡,静置,CCl4层呈橙色,说明含有④Br-;
(3)操作步骤中的现象只能说明可能含有硫酸根离子,但是由于判断出含有SO32-,加入氯水能把其氧化生成SO42-,故SO42-不能确定是否含有;
(4)操作步骤中的现象证明含氯离子,但由于(2)加入了氯离子,所以原溶液是否含氯离子不能确定,据此分析即可.
解答 解:(1)取少许溶液向其中滴加稀盐酸,有刺激性气味气体产生,说明含有⑤SO32-,一定不含+②Ba2+,
(2)另取少许溶液向其中滴加氯水,及CCl4振荡,静置,CCl4层呈橙色,说明含有④Br-;
(3)操作步骤中的现象只能说明可能含有硫酸根离子,但是由于判断出含有SO32-,加入氯水能把其氧化生成SO42-,故SO42-不能确定是否含有;
(4)操作步骤中的现象证明含氯离子,但由于(2)加入了氯离子,所以原溶液是否含氯离子不能确定,
溶液呈电中性,则一定含①Na+,可逆含有的为③Cl-、⑥SO42-,?
依据分析可知一定含有:①④⑤,可能含有:③⑥,
故答案为:①④⑤;③⑥.
点评 本题考查了常见离子的检验方法和产生的现象,萃取操作,离子共存的判断等知识,注意电荷守恒的应用,关键是先肯定离子存在,再否定不共存的离子,本题难度不大.


科目:高中化学 来源: 题型:选择题
| A. | CH3 CH2 CH2CH3 | B. | (CH3)3C C(CH3)3 | ||
| C. | CH3CH(CH3)CH3 | D. | CH3C(CH3)2CH2 CH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光导纤维的主要成分是 SiO2 | |
| B. | 石英玻璃常用来制耐高温的化学仪器 | |
| C. | 硅酸盐工业使用的每一种原料中都含有硅 | |
| D. | 水泥和普通玻璃都是混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 长江三角洲的形成 | |
| B. | 雾天容易看到车灯形成的光柱 | |
| C. | 将植物油倒入水中用力搅拌形成油水混合物 | |
| D. | 向氢氧化铁胶体中加入硫酸溶液先出现浑浊后变澄清 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
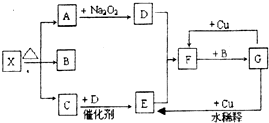 图的各方框表示有关的一种反应物或生成物(某些物质已经略去),X分解所得A、B、C混合气体的平均相对分子质量为24,其中常温下A、C、D为无色气体,B为无色液体,C能使湿润的红色石蕊试纸变蓝.
图的各方框表示有关的一种反应物或生成物(某些物质已经略去),X分解所得A、B、C混合气体的平均相对分子质量为24,其中常温下A、C、D为无色气体,B为无色液体,C能使湿润的红色石蕊试纸变蓝.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
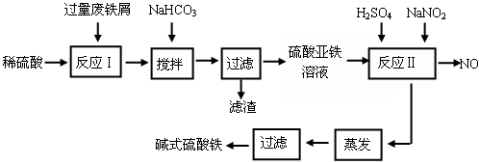
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知一定温度和压强下,在起始容积为V L的容器中充入1mol A和1mol B,保持恒温恒压下反应:A(g)+B(g)?C(g)△H>0.达到平衡时,C的体积分数为40%.试回答:
已知一定温度和压强下,在起始容积为V L的容器中充入1mol A和1mol B,保持恒温恒压下反应:A(g)+B(g)?C(g)△H>0.达到平衡时,C的体积分数为40%.试回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com