
分析 丙炔的分子式为C4H6,与氢气发生的反应有:①C4H6+H2→C4H8②C4H8+H2→C4H10③C4H6+2H2→C4H10,
当V(C4H6):V(H2)≥1时,反应仅按照①进行;当V(C4H6):V(H2)≤$\frac{1}{2}$时,反应按③进行;当$\frac{1}{2}$<V(C4H6):V(H2)<1时,部分按①进行,部分按③反应,
当V(C4H6):V(H2)≥$\frac{1}{2}$时,无论发生①或③,得到的产物是C4H8还是C4H10或它们的混合物,剩余气体的体积等于反应物C4H6的体积,
当V(C4H6):V(H2)<$\frac{1}{2}$时,氢气过量,剩余气体为的C4H10和H2的混合物,气体体积为C4H6和剩余H2的混合物,
(1)若恰好反应,则V(C4H6):V(H2)=1:2,据此计算x;
(2)当氢气不足,则V(C4H6):V(H2)≥$\frac{1}{2}$时,即x≤$\frac{2}{3}$,得到的产物是C4H8、C4H10或它们的混合物,剩余气体的体积等于反应物C4H6的体积;
当氢气过量,则V(C4H6):V(H2)≤$\frac{1}{2}$时,即x>$\frac{2}{3}$,氢气过量,剩余气体的气体体积为C4H6和剩余H2的混合物;
(3)当x=$\frac{2}{3}$,混合气体体积达到最小值,x>$\frac{2}{3}$,随着x的增加,混合气体体积V逐渐增大,当x≤$\frac{2}{3}$,随着x增大气体体积V逐渐减小,据此画出x为不同值时反应后的体积V的图象.
解答 解:(1)若H2体积为1L,则丁炔为4L,发生的反应C4H6+H2→C4H8,减少的体积是氢气的体积,所以反应后的体积为:5L-1L=4L,答:反应后的体积为:4L;(2)当V(C4H6):V(H2)<$\frac{1}{2}$时,即x>$\frac{2}{3}$,氢气过量,剩余气体的气体体积为C4H6和剩余H2的混合物,V=V(C4H6)+V剩余(H2)=5(1-x)L+5x-2×5(1-x)=10x-5,
当氢气不足,V(C4H6):V(H2)≥$\frac{1}{2}$时,即x≤$\frac{2}{3}$,得到的产物是C4H8或C4H10或二者的混合物,剩余气体的体积等于反应物C4H6的体积,V=V(C3H4)=5(1-x)L,答:氢气过量,V=10x-5;当氢气不足,V=5(1-x);
(3)当x=$\frac{2}{3}$时,混合气体体积达到最小值,x>$\frac{2}{3}$,随着x的增加,混合气体体积V逐渐增大,当x≤$\frac{2}{3}$,随着x增大气体体积V逐渐减小,据此画出x为不同值时反应后的体积V的图象为: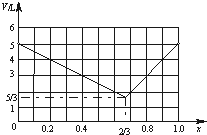 ,
,
答:x为不同值时反应后的体积V的图象为 .
.
点评 本题考查了有关范围讨论的化学计算,题目难度较大,正确书写反应原理并反应反应特点为解答本题的关键,注意掌握有关范围讨论的计算方法,试题培养了学生的分析、理解能力.


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:选择题
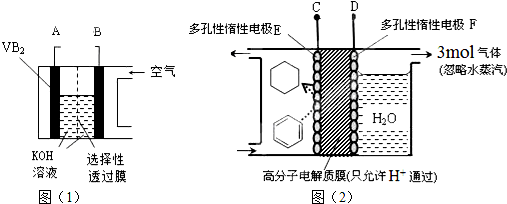
| A. | 整套装置工作时的连接为A连接D、B连接C | |
| B. | VB2极发生的电极反应为:2VB2+22OH--22e-═V2O5+2B2O3+11H2O | |
| C. | 电极F产生3mol气体时电极E得到的氧化产物为2mol | |
| D. | 储氢装置工作时,右侧电极区的pH值减小2×10-9 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
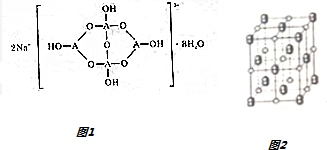

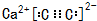 ,若晶胞的长、宽、高分别为520pm、520pm和690pm,则该晶体的密度为2.28g/cm3(精确至0.01)
,若晶胞的长、宽、高分别为520pm、520pm和690pm,则该晶体的密度为2.28g/cm3(精确至0.01)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
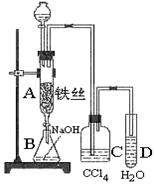 某化学课外小组用图装置使苯与液溴反应.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.
某化学课外小组用图装置使苯与液溴反应.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3 种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
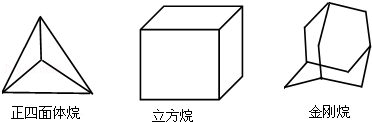
| A. | 2种 4种 8种 | B. | 2种 4种 6种 | C. | 1种 3种 6种 | D. | 1种 3种 8种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com