
【题目】硝酸在有机合成、医药化工、化纤等行业应用非常广泛。工业上用氨催化氧化法可生产硝酸,其生产过程可表示为:
4NH3+5O2![]() 4NO+6H2O ----①
4NO+6H2O ----①
4NO+3O2+2H2O→4HNO3----②
完成下列计算:
52、如果以一定量的氨气在一密闭容器中与足量氧气发生上述反应,冷却后所得溶液中溶质的质量分数是_________________(保留2位小数,下同)。
53、现以1.70吨液氨为原料生产硝酸,然后加入4.50吨水,得到密度为1.31g/cm3的硝酸,该硝酸的物质的量浓度是_______mol/L(假设生产过程中反应物和生成物均无损耗)。
54、把22.40 g铁完全溶解于某浓度的硝酸中,反应只收集到 0.30 mol NO2 和0.20 mol NO。通过计算推断反应后溶液中溶质的成分及其物质的量__________(写出计算过程)。
55、硝酸工业尾气中的NO、NO2属于大气的主要污染物。已知1m3硝酸工业的尾气中含3160mg NOx,其中n(NO) : n(NO2) = 9:1。
(1)如果用NaOH溶液完全吸收NOx,至少需要补充标准状况下的富氧空气多少升?
_________________________(富氧空气中O2的体积分数为0.25)(写出计算过程)
(2)如果用氨催化还原法,即用氨作催化剂,将NO、NO2转化为氮气直接排入空气中,需要氨气的质量为多少克?__________________________(写出计算过程)
【答案】0.78 10.40 Fe(NO3)20.3mol、Fe(NO3)3 0.1mol V(富氧空气):1.79 L m(NH3)= 1.25g
【解析】
52.4NH3+5O2![]() 4NO+6H2O ①;4NO+3O2+2H2O→4HNO3②;二者相加得到4NH3+8O2=4HNO3+4H2O,所以硝酸的质量分数为:
4NO+6H2O ①;4NO+3O2+2H2O→4HNO3②;二者相加得到4NH3+8O2=4HNO3+4H2O,所以硝酸的质量分数为:![]() =0.78;
=0.78;
故答案为:0.78;
53.1.70吨液氨的物质的量为:![]() =0.1×106mol,依据转化关系4NH3+8O2=4HNO3+4H2O,可知生成的硝酸的物质的量为0.1×106mol;消耗氧气的物质的量为:0.2×106mol;依据方程式4NH3+8O2=4HNO3+4H2O,可知硝酸溶液的质量=液氨的质量+水的质量+消耗氧气的质量=1.70×106+4.50×106+×32×0.2×106=12.6×106(g);该硝酸溶液的体积V=
=0.1×106mol,依据转化关系4NH3+8O2=4HNO3+4H2O,可知生成的硝酸的物质的量为0.1×106mol;消耗氧气的物质的量为:0.2×106mol;依据方程式4NH3+8O2=4HNO3+4H2O,可知硝酸溶液的质量=液氨的质量+水的质量+消耗氧气的质量=1.70×106+4.50×106+×32×0.2×106=12.6×106(g);该硝酸溶液的体积V=![]() =9.62×103(L),则c(HNO3)=
=9.62×103(L),则c(HNO3)=![]() =10.40(mol/L);
=10.40(mol/L);
故答案为:10.40;
54.铁与浓硝酸反应生成二氧化氮,与稀硝酸反应生成一氧化氮,当硝酸足量时,反应只生成硝酸铁,硝酸不足量时生成硝酸亚铁,设最后溶液中含有硝酸铁物质的量为xmol,硝酸亚铁的物质的量为ymol,则根据得失电子守恒可知铁生成三价铁和二价铁离子失去电子总数等于硝酸还原为二氧化氮和一氧化氮得到电子总数即:3x+2y=0.30mol×(5-4)+0.20mol×(5-2);依据铁原子个数守恒可知:x+y=![]() ,解方程组得x=0.1mol,y=0.3mol;所以最后溶液中含有硝酸铁,物质的量为0.1mol;含有硝酸亚铁,物质的量为0.3mol;
,解方程组得x=0.1mol,y=0.3mol;所以最后溶液中含有硝酸铁,物质的量为0.1mol;含有硝酸亚铁,物质的量为0.3mol;
故答案为:Fe(NO3)2 0.3mol、Fe(NO3)30.1mol;
55.(1)由题意可知:n(NO):n(NO2)=9:1,及总质量为3160mg,设混合气体中含有xmolNO,ymolNO2,则:x:y=9:1; 30x+46y=3.16;解得x=0.09;y=0.01;与一氧化氮气体、二氧化氮混合气体反应,方程式为:NO+NO2+2NaOH=2NaNO2+H2O,根据反应关系可知,n(NO2)=n(NO)=0.01mol;剩余NO物质的量为0.09mol-0.01mol=0.08mol,要想完全被吸收,则只需要用氧气氧化0.04molNO生成0.04mol二氧化氮,依据得失电子守恒得:0.04mol×(4-2)=n(O2)×4,解得n(O2)=0.02mol,标况下体积为:0.02mol×22.4L/mol=0.448L,而富氧空气中O2的体积分数为0.25,所以需要富氧空气的体积为:![]() =1.792L;
=1.792L;
故答案为:1.792L;
(2)由①知1m3硝酸工业的尾气中含3160mgNOx,含有NO0.09mol,含有NO20.01mol,如果用氨催化还原法,即用氨作催化剂,将NO、NO2转化为氮气直接排入空气中,设需要氨气的物质的量为:n(NH3)则依据得失电子守恒可知:0.09mol×(2-0)+0.01mol×(4-0)=n(NH3)×(0-(-3)),解得n(NH3)=![]() mol,其质量为:
mol,其质量为:![]() mol×17g/mol=1.25g;
mol×17g/mol=1.25g;
故答案为:1.25。


科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组根据反应:H2O2+2HI=2H2O+I2探究影响化学反应速率的因素。实验数据如下:
实验 编号 | H2O2溶液浓度/(mol·L-1) | HI溶液浓度/(mol·L-1) | 温度/℃ | 反应速率/(mol·L-1·s-1) |
① | 0.1 | 0.1 | 25 | 0.0076 |
② | 0.1 | 0.2 | 25 | 0.0153 |
③ | 0.1 | 0.3 | 25 | 0.0227 |
④ | 0.1 | 0.1 | 35 | 0.0304 |
回答下列问题:
(1)反应:H2O2+2HI=2H2O+I2中,氧化剂是___。
(2)25℃时,表明增大反应物浓度,化学反应速率___(填“增大”或“减小”)。
(3)能表明温度对化学反应速率影响的实验编号是①和___。
(4)H2O2不稳定,写出H2O2发生分解反应的化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是一种重要的基础化工原料,在一定条件下可发生下列转化:
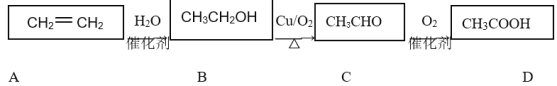
请根据题意填空:
(1)CH3COOH的官能团为________(填“羟基”或“羧基”);
(2)既能使溴水褪色,又能使酸性高锰酸钾溶液褪色的是________(填“A”或“B”);
(3)完成B→C的化学方程式:2CH3CH2OH+O2![]() 2CH3CHO+__________。
2CH3CHO+__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学校化学科研小组从文献资料上获得如下信息:NaHCO3在潮湿的空气中会缓慢分解成Na2CO3、H2O和CO2。为了验证这一信息,该科研小组将一瓶在潮湿空气中久置的NaHCO3样品混合均匀后,进行如下实验:

(1)在一个质量为a g的蒸发皿中加入一些样品,称得总质量为b g。用酒精灯对其充分加热,冷却后称得其总质量为c g。残留在蒸发皿中的固体是(填化学式)_______________。
(2)另称取相同质量的样品放入锥形瓶中,实验装置如右图所示。为了保证实验成功,所选用针筒的最大刻度值应大于或等于__________(mL)。(设实验在标准状况下进行)
(3)打开活塞逐滴加入稀硫酸,至没有气泡产生为止。针筒中收集到气体折算成标准状况下的体积为V mL(滴入稀硫酸的体积及针筒活塞的内壁的摩擦力忽略不计)。该科研小组设称取的每份样品中的Na2CO3、NaHCO3的物质的量分别为x、y,且没有利用化学方程式进行计算,就列出了如下算式:x + y = VmL/22400 mL·mol-1,他们依据的原理是___________。根据相似原理,请完成下列算式:2x + y =___________由上述两算式,该科研小组通过计算,得出了样品中的Na2CO3、NaHCO3的质量分数。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲图为一种新型污水处理装置,该装置可利用一种微生物将有机废水的化学能直接转化为电能。乙图是一种家用环保型消毒液发生器,用惰性电极电解饱和食盐水。下列说法中不正确的是 ( )。
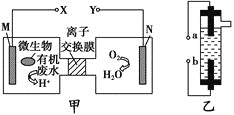
A.装置乙的a极要与装置甲的X极连接
B.装置乙中b极的电极反应式为2Cl--2e-=Cl2↑
C.若有机废水中主要含有葡萄糖,则装置甲中M极发生的电极应为C6H12O6+6H2O-24e-=6CO2↑+24H+
D.N电极发生还原反应,当N电极消耗5.6 L(标准状况下)气体时,则有2NA个H+通过离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)图Ⅰ是1molNO2(g)和1molCO(g)反应生成CO2(g)和NO(g)过程中的能量变化示意图,请写出NO2和CO反应的热化学方程式:__。
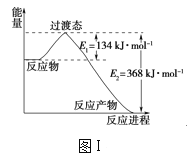
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=49.0kJ·mol-1
②CH3OH(g)+![]() O2(g)=CO2(g)+2H2(g) ΔH=-192.9kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9kJ·mol-1
又知:③H2O(g)=H2O(l) ΔH=-44kJ·mol-1
则甲醇蒸气完全燃烧生成液态水的热化学方程式为__。
(3)下表是部分化学键的键能数据:
化学键 | P—P | P—O | O=O | P=O |
键能/(kJ·mol-1) | a | b | c | x |
已知1molP4(g)完全燃烧生成P4O10(g)放出的热量为dkJ,P4和P4O10的结构如图Ⅱ所示,则上表中x=___(用含有a、b、c、d的代数式表示)。
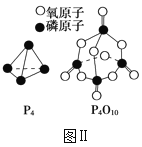
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Y具有抗菌、消炎作用,可由X制得。
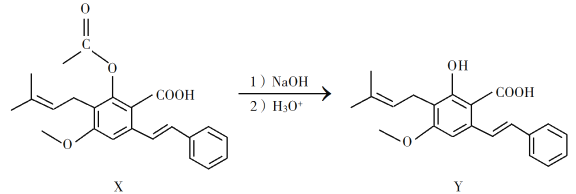
下列有关化合物X、Y的说法正确的是
A. 1 mol X最多能与2 mol NaOH反应
B. Y与乙醇发生酯化反应可得到X
C. X、Y均能与酸性KMnO4溶液反应
D. 室温下X、Y分别与足量Br2加成的产物分子中手性碳原子数目相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以充分说明反应P(g)+Q(g)![]() R(g)+S(g)在恒温下已达到平衡的是( )
R(g)+S(g)在恒温下已达到平衡的是( )
A. 反应容器内的压强不随时间改变
B. 反应容器内P、Q、R、S四者浓度之比为1:1:1:1
C. P的生成速率和S的生成速率相等
D. 反应容器内的气体总物质的量不随时间变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com