
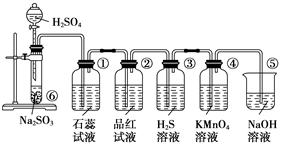
 [
[ 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源:不详 题型:单选题
| A.通过石灰水 | B.先通过酸性KMnO4溶液再通过石灰水 |
| C.通过品红溶液 | D.先通过小苏打溶液再通过石灰水 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.13 | B.0.16 | C.0.22 | D.0.26 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
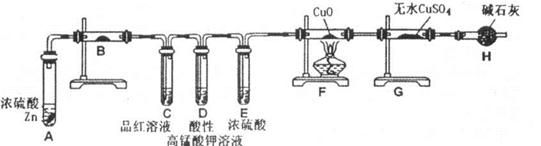
 2CuO,CuO+H2SO4=CuSO4+H2O。
2CuO,CuO+H2SO4=CuSO4+H2O。查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
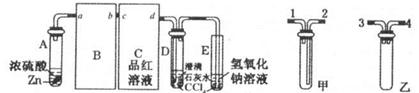
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.硫化氢很稳定,受热难分解 |
| B.将硫化氢通入氯水中,氯水褪色并产生浑浊 |
| C.硫化氢在足量氧气中燃烧生成淡黄色固体 |
| D.硫化氢是弱电解质,其电离方程式是H2S ? 2H+ + S2- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.向溶液中加入FeCl3溶液,产生的沉淀是亚硫酸钡 |
| B.向溶液中加入稀氨水,产生的沉淀是硫酸钡 |
| C.向溶液中加入AgNO3溶液,产生的沉淀是氯化银 |
| D.向溶液中加入NH4Cl溶液,产生亚硫酸钡沉淀 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.浓硫酸具有吸水性,因而能使蔗糖炭化 |
| B.浓硫酸具有强氧化性,常温下可迅速与铜片反应放出二氧化硫气体 |
| C.浓硫酸具有脱水性,常用作气体的干燥剂 |
| D.浓硫酸具有强氧化性,常温下能使铁、铝等金属表面形成氧化膜而钝化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com