
| A. | 1molCH3+(碳正离子)中含有电子数为10NA | |
| B. | 1mol铜与足量硫蒸气反应,转移电子数为2NA | |
| C. | 用惰性电极电解CuCl2溶液,阴极析出32g铜时,线路中通过的电子数为NA | |
| D. | 0.84g NaHCO3晶体中阳离子和阴离子总数为0.03NA |
分析 A.碳正离子中含有8个电子,1molCH3+(碳正离子)中含有8mol电子;
B.铜与硫反应生成硫化亚铜,1mol铜与足量硫蒸气反应失去1mol电子;
C.依据电解反应和电子守恒计算分析;
D.根据碳酸氢钠晶体中含有的离子为钠离子和碳酸氢根离子判断.
解答 解:A.1molCH3+(碳正离子)中含有8mol电子,含有电子数为8NA,故A错误;
B.1mol铜与足量硫蒸气反应生成0.5mol硫化亚铜,转移了1mol电子,转移电子数为NA,故B错误;
C.依据电极反应和电子守恒计算分析,用惰性电极电解CuCl2溶液,阴极析出32g铜时物质的量为0.5mol,Cu2++2e-=Cu,线路中通过的电子数为NA,故C正确;
D.0.84gNaHCO3晶体的物质的量为0.01mol,含有0.01mol钠离子和0.01mol碳酸氢根离子,含有的阳离子和阴离子总数为0.02NA,故D错误;
故选:C.
点评 本题考查了阿伏伽德罗常数,题目难度不大,注意碳酸氢钠固体中的离子为钠离子和碳酸氢根离子.


 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:解答题
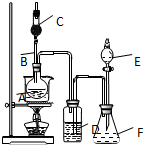 为证明乙醇分子中含有氧原子,运用R-OH+HCl═RCl+H2O反应生成的水(H2O),检测其中的氧.现采用一套如图所示装置进行实验. 装置中所装的试剂:
为证明乙醇分子中含有氧原子,运用R-OH+HCl═RCl+H2O反应生成的水(H2O),检测其中的氧.现采用一套如图所示装置进行实验. 装置中所装的试剂:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
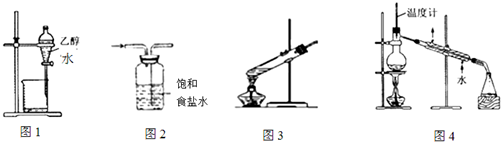
| A. | 图1装置用于分离乙醇和水 | B. | 图2装置用于除去氯气中的氯化氢 | ||
| C. | 图3装置用于葡萄糖的银镜反应 | D. | 图4装置用于石油的蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=3的无色溶液:Na+、Cl-、Fe2+、ClO- | |
| B. | 使石蕊溶液变红的溶液:Na+、Cl-、SO42-、AlO2- | |
| C. | 与Al产生H2的溶液:K+、SO42-、CO32-、NH4+ | |
| D. | 水电离的c(H+)=1×10-12 mol•L-1的溶液:K+、Ba2+、Cl-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体熔点的高低: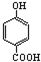 > >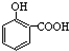 | |
| B. | 原子的价层电子数目的多少:Fe>As>K | |
| C. | 分子中的键角大小:CO2>H2O>NH3 | |
| D. | 微粒半径的大小:O2->F->Na+>Li+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4H是离子化合物 | |
| B. | NH4H溶于水,所形成的溶液显酸性 | |
| C. | NH4H与水反应时,NH4H是还原剂 | |
| D. | NH4H固体投入少量的水中,有两种气体生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
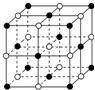 X、Y、Z、W为按原子序数由小到大排列的四种短周期元素,已知:
X、Y、Z、W为按原子序数由小到大排列的四种短周期元素,已知: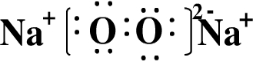 ,含有的化学键类型为离子键和共价键,Z2Y2为离子晶体.
,含有的化学键类型为离子键和共价键,Z2Y2为离子晶体.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com