
| A. | 洗涤油污常用热的碳酸钠溶液 | |
| B. | 无法利用Na2S溶液和AlCl3溶液制备Al2S3 | |
| C. | 金属焊接中,可用NH4Cl溶液作除锈剂 | |
| D. | 工业上用FeCl3溶液腐蚀铜制印刷电路板 |
分析 A、碳酸钠水解呈碱性,加热促进水解,有利于除去油污;
B、铝离子在溶液中水解生成氢氧化铝和氢离子,硫离子水解生成硫化氢和氢氧根离子,二者相互促进,据此分析;
C、铵根离子水解显酸性,可以和氧化铁反应;
D、氯化铁与铜反应生成氯化亚铁和氯化铜.
解答 解:A、碳酸钠水解呈碱性,加热促进水解,且油污在碱性条件下水解,有利于除去油污,故A正确;
B、铝离子在溶液中水解生成氢氧化铝和氢离子,硫离子水解生成硫化氢和氢氧根离子,二者相互促进,则AlCl3溶液和Na2S水溶液混合发生的反应为:2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑,不能制得Al2S3,故B正确;
C、氯化铵中铵根离子水解显酸性,可以和铁锈成分氧化铁反应,盐的水解有关,故C正确;
D、氯化铁与铜反应生成氯化亚铁和氯化铜,反应化学方程式:2FeCl3+Cu=2FeCl2+CuCl2,和盐的水解无关,故D错误;
故选D.
点评 本题考查了盐的水解原理的应用,题目难度不大,注意发生相互促进的水解时反应能完全进行到底生成沉淀和气体.


科目:高中化学 来源: 题型:选择题

| A. | 该试剂的物质的量浓度为9.2 mol•L-1 | |
| B. | 该硫酸50 mL与足量的铜反应可得到标准状况下SO2 10.3 L | |
| C. | 硫酸是强电解质 | |
| D. | 该硫酸与等体积的水混合所得溶液的质量分数小于49% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解水生成H2和O2时,化学能主要转化为电能 | |
| B. | 风力发电时,风能主要转化为电能 | |
| C. | 煤燃烧时,热能主要转化为化学能 | |
| D. | 白炽灯工作时,只发生电能转化为光能 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
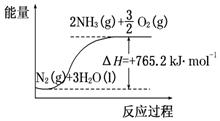 一种“人工固氮”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+3H2O?2NH3+$\frac{3}{2}$O2进一步研究NH3生成量与温度的关系,部分实验数据见表(反应时间3h):
一种“人工固氮”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+3H2O?2NH3+$\frac{3}{2}$O2进一步研究NH3生成量与温度的关系,部分实验数据见表(反应时间3h):| T/℃ | 30 | 40 | 50 |
| 生成NH3量/(10-6 mol) | 4.8 | 5.9 | 6.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
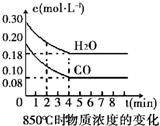
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | C1 | C2 | C3 | C3 |
| 4 | C1 | C2 | C3 | C3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.5mol | B. | 1.5mol | C. | 3mol | D. | 3.25mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤⑦ | B. | ①②③⑥⑦ | C. | ①②④⑦ | D. | ②③⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
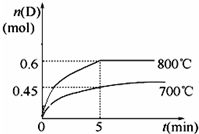
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
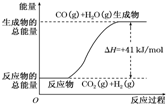 (1)已知14g N2与足量H2反应放出46kJ的热量,则该反应的热化学方程式是N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ/mol
(1)已知14g N2与足量H2反应放出46kJ的热量,则该反应的热化学方程式是N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ/mol →
→
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com