
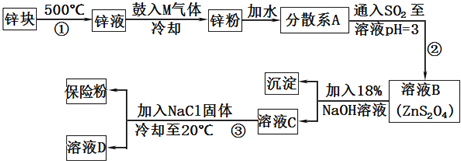
分析 锌块加热融化,向锌液中鼓入M气体,使液态锌雾化,冷却得到锌粉,加水形成分散系,再通入二氧化硫反应得到ZnS2O4,加入NaOH溶液反应得到氢氧化锌沉淀、Na2S2O4,最后加入NaCl降低Na2S2O4的溶解度,析出Na2S2O4,溶液D中含有NaCl.
(1)常用来制做耐高温坩埚的金属氧化物为氧化铝;
(2)由锌块制备锌粉,增大锌反应的表面积;鼓入气体M为常见的化合物,可以是二氧化碳,冷却得到粒度约为180μm的锌粉,分散系A为悬浊液;
(3)流程②步骤中Zn与二氧化硫反应生成ZnS2O4;
(4)流程③是分离固体与溶液,分离方法为过滤、洗涤、干燥,为减少溶解导致的损失,用甲醇洗涤,过滤前加入NaClNa+ 浓度增大,便于Na2S2O4结晶析出;
(5)反应后溶液中有纳米级的银粉生成,根据电子转移守恒,可知S2O42-氧化生成SO32-.
解答 解:锌块加热融化,向锌液中鼓入M气体,使液态锌雾化,冷却得到锌粉,加水形成分散系,再通入二氧化硫反应得到ZnS2O4,加入NaOH溶液反应得到氢氧化锌沉淀、Na2S2O4,最后加入NaCl降低Na2S2O4的溶解度,析出Na2S2O4,溶液D中含有NaCl.
(1)常用来制做耐高温坩埚的金属氧化物为Al2O3,故答案为:Al2O3;
(2)由锌块制备锌粉的目的是:增大锌反应的表面积,加快化学反应速率;向锌液中鼓入M气体,使液态锌雾化,冷却得到粒度约为180μm的锌粉.鼓入气体M为常见的化合物,则M的化学式为CO2,分散系A为悬浊液,
故答案为:增大锌反应的表面积,加快化学反应速率;CO2;悬浊液;
(3)流程②步骤中Zn与二氧化硫反应生成ZnS2O4,反应方程式为:Zn+2SO2=ZnS2O4,
故答案为:Zn+2SO2=ZnS2O4;
(4)流程③是分离固体与溶液,分离方法为过滤、洗涤、干燥,为减少溶解导致的损失,用甲醇洗涤,过滤前加入NaCl增大Na+ 浓度,便于Na2S2O4结晶析出,
故答案为:过滤;甲醇;增大Na+ 浓度,便于Na2S2O4结晶析出;
(5)反应后溶液中有纳米级的银粉生成,Ag元素发生还原反应,S元素发生氧化反应,设S元素在氧化产物中化合价为a,则VL×0.04mo1•L-1×1=VL×0.02mol•L-1×2×(a-3),解得a=4,故S2O42-氧化生成SO32-,反应离子方程式为:2Ag++S2O42-+4OH-=2Ag+2SO32-+2H2O,
故答案为:2Ag++S2O42-+4OH-=2Ag+2SO32-+2H2O.
点评 本题考查物质准备工艺流程、陌生方程式的书写、物质的分离提纯等,注意对题目信息的获取与迁移应用,是对学生综合能力的考查.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
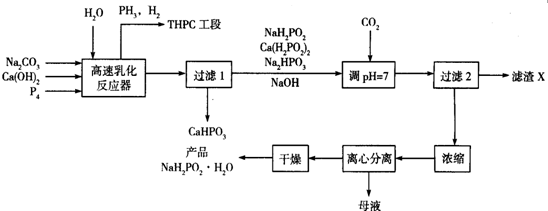
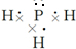 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在pH=1的溶液中:K+、Na+、SO42-、HCO3- | |
| B. | 在0.1 mol•L-1 Na2CO3溶液中:Al3+、K+、NO3-、SO42- | |
| C. | 在0.1 mol•L-1 FeCl3溶液中:K+、NH4+、I-、SCN- | |
| D. | 在pH=12的溶液中:K+、Na+、ClO-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
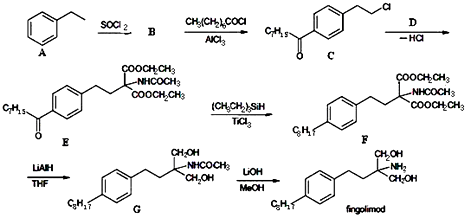
 .
.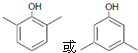 .
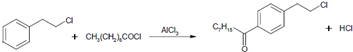
.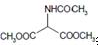 等主要原料,合成医药中间体:
等主要原料,合成医药中间体: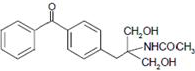 (无机原料任选).合成路线流程图示例如下:
(无机原料任选).合成路线流程图示例如下: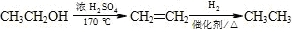
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2的电子式为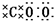 | |
| B. | 所有的主族元素的简单离子的化合价与其族序数相等 | |
| C. | NH4Cl晶体中,既含有离子键,又含有共价键 | |
| D. | 下列物质均为极性分子:H2O、NH3、CCl4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热 | B. | 不用稀硫酸,改用98%浓硫酸 | ||
| C. | 将铁片改为镁条 | D. | 不用铁片,改用铁粉 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com