
| A. | 向品红溶液中通入气体X,品红溶液褪色,则气体X可能是Cl2 | |
| B. | CO2中含少量SO2,可将该混合气体通入足量的饱和NaHCO3溶液中除去SO2 | |
| C. | 用洁净的铂丝蘸取某食盐,在酒精灯火焰上灼烧,火焰显黄色,说明该食盐中不含KIO3 | |
| D. | 向NaHCO3溶液中滴加酚酞试液,加热时溶液由浅红色变成红色,冷却后溶液由红色变成淡红色,说明HCO3-在水溶液中存在水解平衡 |
分析 A、二氧化硫、氯气都可以使品红溶液褪色;
B、除去混入CO2中的SO2,所选用的试剂能够将二氧化硫除去且不能够与二氧化碳反应、不能引进新的杂质;
C、钾的焰色反应能被钠的焰色反应所掩盖,观察钾的焰色反应要透过蓝色钴玻璃;
D、NaHCO3溶液和酚酞试液的试管,在室温时,溶液为无色,加热时为粉红色,因为碳酸氢根离子水解显碱性,水解过程是吸热过程,加热促进水解,碱性增强;
解答 解:A、二氧化硫能够与有机色素化合生成无色物质,具有漂白性,但是生成的无色化合物不稳定受热易恢复颜色,所以二氧化硫的漂白性具有不稳定的特点,氯气与水反应生成的次氯酸具有强的氧化性,具有漂白性,但是其漂白效果稳定,受热不恢复颜色,所以气体X可能是Cl2,故A正确;
B、饱和NaHCO3溶液既可除去SO2,碳酸氢钠与二氧化碳不反应,又可增加CO2,故B正确;
C、钾的焰色反应能被钠的焰色反应所掩盖,观察钾的焰色反应要透过蓝色钴玻璃,则该实验中不能确定是否含KIO3,故C错误;
D、碳酸氢钠水解生成氢氧化钠和碳酸,加热促进水解平衡正向进行,水解过程是吸热过程,加热促进水解,碱性增强,溶液由浅红色变成红色,冷却后平衡逆向进行,溶液由红色变成淡红色,故D正确;
故选C.
点评 本题考查了盐类水解的分析判断,物质性质的理解应用,主要是影响水解平衡的影响因素温度的改变对平衡的影响分析,题目难度中等.


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
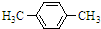 +Br2$\stackrel{FeBr_{3}}{→}$
+Br2$\stackrel{FeBr_{3}}{→}$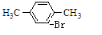 +HBr.
+HBr.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用四氯化碳可以萃取乙酸水溶液中的乙酸 | |
| B. | 丁烷有两种同分异构体 | |
| C. | 乙烯可以与氢气发生加成反应,也可发生自身加聚反应生成聚乙烯 | |
| D. | 纤维素、淀粉和蛋白质都是高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
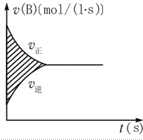
| A. | A浓度的减小量 | B. | B浓度的减小量 | ||
| C. | C物质的量的增加量 | D. | B物质的量的减少量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
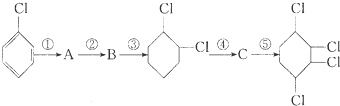
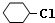 ,B:
,B: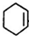 ,C:
,C: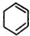 .
.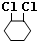 +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$ +2NaCl+2H2O、
+2NaCl+2H2O、 +2Cl2→
+2Cl2→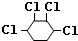 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Fe | H2O(g) | Fe3O4 | H2 | |
| 起始/mol | 3.0 | 4.0 | 0 | 0 |
| 平衡/mol | m | n | p | Q |
| Fe | H2O(g) | F3O4 | H2 | |
| A/mol | 3.0 | 4.0 | 0 | 0 |
| B/mol | 0 | 0 | 1.0 | 4.0 |
| C/mol | m | n | p | Q |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com