
| A. | 硅太阳能电池工作时,光能转化成电能 | |
| B. | 锂离子电池放电时,化学能转化成电能 | |
| C. | 电解质溶液导电时,电能转化成化学能 | |
| D. | 葡萄糖为人类生命活动提供能量时,化学能转化成热能 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 水泥、水玻璃、水晶均属于硅酸盐产品 | |
| B. | 医用酒精和葡萄糖注射液可用丁达尔效应区分 | |
| C. | 氯水和食盐水消毒杀菌的原理相同 | |
| D. | 铵态氮肥和草木灰混合使用会降低肥效 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖类化合物也可称为碳水化合物 | |
| B. | 维生素D可促进人体对钙的吸收 | |
| C. | 蛋白质是仅由碳、氢、氧元素组成的物质 | |
| D. | 硒是人体必需的微量元素,但不宜摄入过多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 化合物 | SiCl4 | TiCl4 | AlCl3 | FeCl3 | MgCl2 |
| 沸点/℃ | 58 | 136 | 181(升华) | 316 | 1412 |
| 熔点/℃ | -69 | 25 | 193 | 304 | 714 |
| 在TiCl4中的溶解性 | 互溶 | - | 微溶 | 难溶 | |
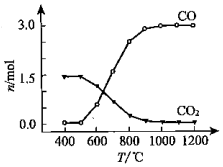
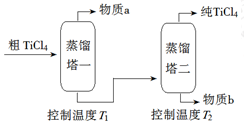
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
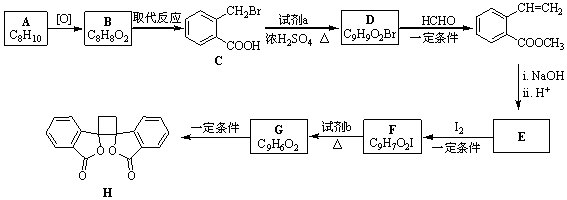
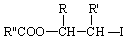
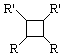
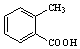 .
.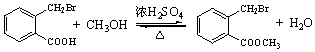 .
. ;此反应同时生成另外一个有机副产物且与F互为同分异构体,此有机副产物的结构简式是
;此反应同时生成另外一个有机副产物且与F互为同分异构体,此有机副产物的结构简式是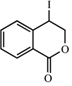 .
.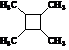 路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).
路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
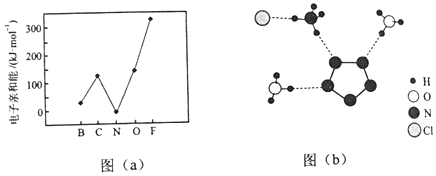
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色透明的溶液中:Fe3+、Mg2+、SCN -、Cl - | |
| B. | c(H+)/c(OH-)=1×10 -12的溶液中:K+、Na+、CO32-、NO3- | |
| C. | c(Fe2+ )=1 mol•L-1的溶液中:K+、NH4+、MnO4-、SO42- | |
| D. | 能使甲基橙变红的溶液中:Na+、NH4+、SO42-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
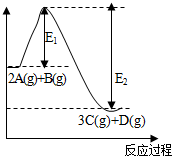 反应2A(g)+B(g)?3C(g)+D(g),△H=akJ/mol.反应过程中的能量变化如图所示.回答下列问题:
反应2A(g)+B(g)?3C(g)+D(g),△H=akJ/mol.反应过程中的能量变化如图所示.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com