
| A、HCl+NaOH |
| B、FeCl3+NaOH |
| C、Fe+CuSO4 |
| D、NaCl+AgNO3 |


科目:高中化学 来源: 题型:
| ||
| ||
| ||
| ||
| A、①② | B、②③ | C、③④ | D、①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一氟一氯甲烷只有一种结构,可以证明甲烷是正四面体结构 |
| B、乙烯和甲苯分子中所有原子都在同一个平面上 |
| C、邻二甲苯没有同分异构体表明苯的凯库勒结构式存在局限,不准确 |
D、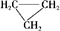 和CH3-CH═CH2互为同分异构体 和CH3-CH═CH2互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石油分馏时分子中碳原子数较少的烃先汽化 |
| B、石油分馏得到的汽油是纯净物 |
| C、石油的分馏和煤的干馏都是化学变化 |
| D、将煤直接加强热使其分解,叫做煤的干馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、当A接外接电源负极时,Li+脱离离子存储层 |
| B、当A接外接电源正极时,电致变色层发生反应为:LiWO3-e-=WO3+Li+ |
| C、当B接外接电源负极时,膜的透射率降低,可以有效阻挡阳光 |
| D、该电致变色系统在较长时间的使用过程中离子导体层中Li+的量可保持基本不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com