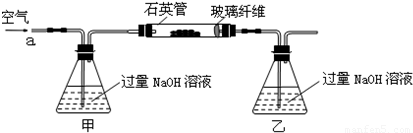
解:(1)空气中含有二氧化碳,能和乙中的氢氧化钠反应生成碳酸钠,碳酸钠和氯化钡反应生成碳酸钡导致沉淀量增大,从而导致干扰硫元素的测定,所以要把空气中二氧化碳除去,用氢氧化钠或氢氧化钾溶液除去即可,所以甲中盛放的是氢氧化钠溶液或氢氧化钾溶液;乙中二氧化硫和氢氧化钠反应生成亚硫酸钠,离子方程式为 SO
2+2OH
-=SO
32-+H
2O,亚硫酸钠和氧气反应生成硫酸钠,离子方程式为2SO
32-+O
2=2SO
42-,
故答案为:除去空气中的CO
2,使乙装置中的溶液只吸收黄铁矿煅烧产生的SO
2;使乙装置中的溶液只吸收黄铁矿煅烧产生的SO
2;SO
2+2OH
-=SO
32-+H
2O;2SO
32-+O
2=2SO
42-;
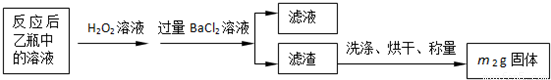
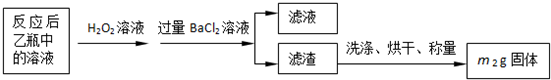
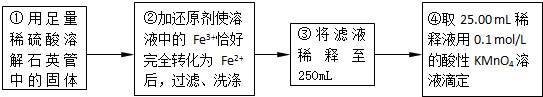
(2)为使亚硫酸根离子完全转化为硫酸根离子,加入的双氧水要足量;
故答案为:使SO
32-完全氧化为SO
42-;
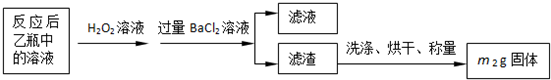
(3)最终所得沉淀是硫酸钡,根据硫原子守恒得硫的质量,设硫的质量为x,
S-----BaSO
432g 233g
x m
2g
x=
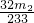
g
质量分数=
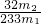
×100%;
故答案为:
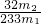
×100%.
(4)铁和铁离子反应生成的亚铁离子物质的量增大,用高锰酸钾物质的量增大,测定结果偏大;
故答案为:偏大;
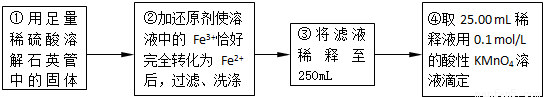
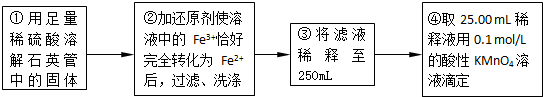
(5)④中取稀释液25.00ml,溶液是酸性溶液,体积数据要求到小数点后两位,需用的仪器是酸式滴定管,Ⅲ的步骤③中,一定物质的量浓度溶液的配制中,除了烧杯、玻璃棒、胶头滴管外,还需要250mL容量瓶,容量瓶装置图为:
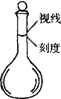
,故答案为:250mL容量瓶;
(6)依据实验流程分析亚铁离子被高锰酸钾溶液滴定发生氧化还原反应,依据消耗的高锰酸钾溶液体积平均数,结合氧化还原反应离子方程式计算25ml溶液中亚铁离子的物质的量滴定亚铁离子的浓度;滴定过程中高锰酸钾溶液平均消耗体积=
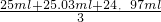
=25ml;
氧化还原反应为:5Fe
2++MnO
4-+8H
+=Mn
2++5Fe
3++4H
2O,设亚铁离子物质的量为x,依据方程式计算得到:
5Fe
2++MnO
4-+8H
+=Mn
2++5Fe
3++4H
2O
5 1
x 0.1mol/L×0.025L
x=0.0125mol;
c(Fe
2+)=
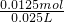
=0.5mol/L;
故答案为:0.5mol/L;
分析:(1)为防止二氧化碳的干扰,应将空气中的二氧化碳用碱液除掉;二氧化硫能和氢氧化钠反应生成盐;亚硫酸根离子能被氧气氧化生成硫酸根离子;
(2)为减少实验误差,最后使完全转化成SO
42-,从而完全生成硫酸钡沉淀;双氧水足量时才能将亚硫酸根离子完全转化;
(3)根据硫原子守恒计算硫铁矿中硫的质量,从而计算其质量分数;
(4)铁和铁离子反应生成的亚铁离子物质的量增大;
(5)根据一定物质的量浓度溶液的配制中各仪器的作用选取仪器;
(6)依据实验过程和滴定实验消耗的高锰酸钾溶液体积的平均数,结合氧化还原反应离子方程式计算亚铁离子物质的量,计算25ml溶液中亚铁离子的浓度;
点评:本题考查了探究物质的含量实验,滴定实验的方法和计算,溶液配制方法和仪器的使用方法,根据元素化合物的性质来分析解答即可,难度不大,注意为防止空气中二氧化碳的干扰.

 2Fe2O3+8SO2
2Fe2O3+8SO2  2Fe2O3+4SO2
2Fe2O3+4SO2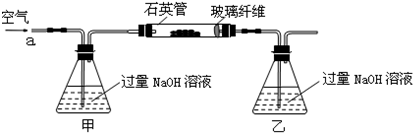
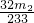 g
g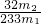 ×100%;
×100%;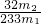 ×100%.
×100%. ,故答案为:250mL容量瓶;
,故答案为:250mL容量瓶;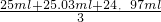 =25ml;
=25ml;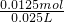 =0.5mol/L;
=0.5mol/L;

 阅读快车系列答案
阅读快车系列答案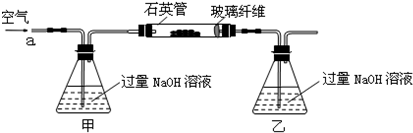




 2Fe2O3+8SO2
2Fe2O3+8SO2  2Fe2O3+4SO2
2Fe2O3+4SO2