

 .
.
分析 利用钼精矿(主要成分是MoS2)制备钼酸钠有两种途径:途径Ⅰ是先在空气中灼烧生成MnO3,同时得到对环境有污染的气体SO2,然后再用纯碱溶液溶解MnO3,即可得到钼酸钠溶液,最后结晶得到钼酸钠晶体;途径Ⅱ是直接用NaClO溶液在碱性条件下氧化钼精矿得到钼酸钠溶液,结晶后得到钼酸钠晶体;据此分析解答:
(1)NaClO是离子型化合物,含有Na+和ClO-;
(2)通常可以增加空气的流通量、固体粉碎或逆流焙烧等措施来提高焙烧效率;
(3)途径I碱浸时MoO3和纯碱溶液反应生成钼酸钠,同时得到CO2气体,反应方程式为MoO3+Na2CO3=Na2MoO4+CO2↑;
(4)途径Ⅱ用NaClO在碱性条件下氧化MoO3,得到钼酸钠和NaCl和水,据此可写出离子反应方程式;
(5)四钼酸铵[(NH4)2MoO4]和氢氧化钠反应可生成NH3,途径Ⅰ中生成的气体有CO2和SO2,将NH3和CO2或SO2一起通入水中可生成碳酸盐或亚硫酸盐和水,反应方程式为CO2+2NH3+H2O=(NH4)2CO3或NH3+H2O+CO2=NH4HCO3,前者生成的盐为正盐,后者为酸式盐;
(6)①根据图象分析,在缓蚀剂中碳钢的腐蚀速率速率最小,腐蚀效果最好,最好的腐蚀效果在中点处;
②浓硫酸有强氧化性,能使金属表面形成致密的氧化膜保护层;
③根据图示数据分析碳钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异的原因.
解答 解:利用钼精矿(主要成分是MoS2)制备钼酸钠有两种途径:途径Ⅰ是先在空气中灼烧生成MnO3,同时得到对环境有污染的气体SO2,然后再用纯碱溶液溶解MnO3,即可得到钼酸钠溶液,最后结晶得到钼酸钠晶体;途径Ⅱ是直接用NaClO溶液在碱性条件下氧化钼精矿得到钼酸钠溶液,结晶后得到钼酸钠晶体;据此分析解答:
(1)离子化合物NaClO的电子式为 ,故答案为:
,故答案为: ;
;
(2)提高焙烧效率,除增大空气量外还可以采用的措施是充分粉碎或逆流焙烧,故答案为:充分粉碎或逆流焙烧;
(3)途径I碱浸时发生反应的离子方程式为MoO3+CO32-=MnO42-+CO2↑,故答案为:MoO3+CO32-=MoO42-+CO2↑;
(4)途径Ⅱ用NaClO在碱性条件下氧化MoO3,发生反应的离子方程式为MnS2+9ClO-+6OH-=MoO42-+9Cl-+2SO42-+3H2O,故答案为:MoS2+9ClO-+6OH-=MoO42-+9Cl-+2SO42-+3H2O;
(5)CO2和NH3一起通入水中生成的正盐为碳酸铵,化学式为(NH4)2CO3,如果是SO2气体则生成正盐为(NH4)2SO3,故答案为:(NH4)2CO3或(NH4)2SO3;
(6)①根据图示可知,当钼酸钠、月桂酸肌氨酸浓度相等时,腐蚀速率最小,腐蚀效果最好,即浓度比为1:1,答案为:1:1;
②当硫酸的浓度大于90%时,腐蚀速率几乎为零,原因是常温下浓硫酸具有强氧化性,会使铁钝化,起到防腐蚀作用,故答案为:常温下浓硫酸具有强氧化性,会使铁钝化;
③由图示数据可知,碳钢在盐酸中的腐蚀速率明显快于硫酸的腐蚀速度;硫酸浓度增大变成浓硫酸后,发生了钝化现象,腐蚀速度很慢,故答案为:Cl-有利于碳钢的腐蚀,SO42-不利于碳钢的腐蚀.
点评 本题考查制备钼酸钠晶体的工业制备方法,涉及利用化学用语分析反应原理,解题关键是分析题中图示,最后一问有一定的难度,容易出错,本题难度中等.


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:选择题
| A. | 在10g质量分数为46%的乙醇水溶液中含有H原子数目为1.2NA | |
| B. | 标准状况下22.4LNO与11.2LO2混合后气体的分子数为2NA | |
| C. | 4.0gH2与足量O2完全反应生成水,反应中断裂共价键数目为2NA | |
| D. | 常温常压下,将0.1molFe投入足量浓硝酸中,转移电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,正极发生的反应是 Pb+SO4+2e═PbSO4 | |
| B. | 放电时,该电池的负极材料是铅板 | |
| C. | 放电时,电池中硫酸的浓度不断变大 | |
| D. | 放电时,每当消耗 1 mol 铅时转移电子 4 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验变量 实验序号 | 银氨溶液的量/mL | |||
| 1 | ||||
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使酚酞变红的溶液中:Mg2+、Al3+、NO3-、ClO- | |
| B. | 与Al反应能放H2的溶液中:Na+、Cu2+、NO3-、I- | |
| C. | 0.1 mol•L-1Na2CO3溶液中:NH4+、K+、SO42-、Cl- | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×1012的溶液中:Ca2+、Na+、SiO32-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
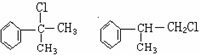
 (X为卤素原子)
(X为卤素原子) 的物质,该物质是一种香料.
的物质,该物质是一种香料.
 ;
;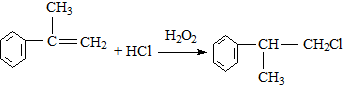 ;
; 的水解产物
的水解产物  ,不能被氧化生成D,若直接转化为D则会降低D的产率与纯度;
,不能被氧化生成D,若直接转化为D则会降低D的产率与纯度; 等任意一种.
等任意一种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤⑥⑦ | B. | ①②④⑤ | C. | ①②⑤⑥ | D. | ③④⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钾与水反应:2K+2H2O=2K++2OH-+H2↑ | |
| B. | 铜片放入稀硝酸中:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O | |
| C. | 氯气通入碘化钾溶液中:Cl2+2I-=2Cl-+I2 | |
| D. | 醋酸与碳酸钠溶液反应:2CH3COOH+CO32-=2CH3COO-+H2O+CO2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com