
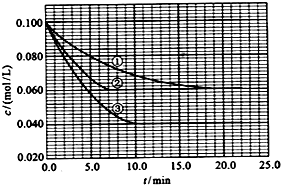
 某温度下,体积和pH都相同的稀硫酸和硫酸铝溶液加水稀释时的pH变化曲线如图,下列有关说法正确的是( )
某温度下,体积和pH都相同的稀硫酸和硫酸铝溶液加水稀释时的pH变化曲线如图,下列有关说法正确的是( )| A. | 加等量的水后硫酸中水电离出的C(H+)与硫酸铝中水电离出的C(H+)的比值比稀释前的比值增大 | |
| B. | a点溶液中有:c(H+)+c(Al3+)=c(OH-)+c(SO42-) | |
| C. | 体积和pH都相同的稀硫酸和硫酸铝溶液与等浓度的NaOH反应,消耗NaOH的体积相等 | |
| D. | b、c两溶液水电离出的c(OH-)相等 |
分析 A、加水稀释,硫酸中水的电离程度增加,硫酸铝中铝离子的水解程度增大,水的电离程度增加;
B、a点溶液中存在电荷守恒,据此回答判断;
C、pH都相同的稀硫酸和硫酸铝溶液中氢离子的浓度相等,根据硫酸、硫酸铝和氢氧化钠的反应来回答;
D、硫酸对水的电离起抑制作用,硫酸铝对水的电离起到促进作用.
解答 解:A、加水稀释,硫酸中氢离子浓度减小,对水的电离抑制作用减小,硫酸中中水的电离程度增加,稀释硫酸铝,硫酸铝中铝离子的水解程度增大,水的电离程度增加,但是铝离子浓度减小,其中水的电离程度增加值不如稀释硫酸过程水的电离程度增加的大,即加等量的水后硫酸中水电离出的C(H+)与硫酸铝中水电离出的C(H+)的比值比稀释前的比值增大,故A正确;
B、a点溶液中存在电荷守恒:c(H+)+3c(Al3+)=c(OH-)+2c(SO42-),故B错误;
C、pH都相同的稀硫酸和硫酸铝溶液中氢离子的浓度相等,但是它们和氢氧化钠反应的实质不一样,前者是氢离子和氢氧根离子的反应,但是后者是铝离子和氢氧根离子之间的反应,氢离子和铝离子的物质的量不相等,故C错误;
D、硫酸对水的电离起抑制作用,硫酸铝对水的电离起到促进作用,b、c两溶液水电离出的c(OH-),硫酸电离出的氢离子浓度抑制了水的电离,所以c点溶液中水的电离程度最小,故D错误.
故选A.
点评 本题考查酸溶液的稀释,注意弱电解质溶液稀释时的浓度变化及加水促进弱电解质电离的特点即可解答,题目难度中等.


科目:高中化学 来源: 题型:选择题
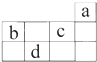
| A. | a原子的最外电子层上有8个电子 | |
| B. | c的最高价氧化物对应水化物为强酸 | |
| C. | d的原子半径比c的原子半径大 | |
| D. | b的气态氢化物比c的气态氢化物稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 431kJ•mol-1 | B. | 945.6kJ•mol-1 | C. | 649kJ•mol-1 | D. | 896kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通过导电实验证明氢氧化铁胶体带正电 | |
| B. | 除去苯中溶有的少量乙醇,加入水,振荡,然后分液 | |
| C. | 进行蒸馏操作时.应用温度计准确测量沸腾液体的温度 | |
| D. | 从海带中提取碘时用到的药品有双氧水和NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
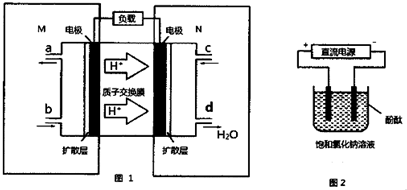
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位.
稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com