
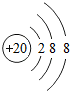
 ,
, ;
;

科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
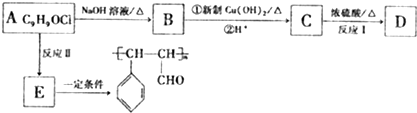
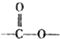 结构的芳香族化介物的同分异构体有
结构的芳香族化介物的同分异构体有查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除去NO中混有的NO2将混合气体先通过足量水,然后用CaCl2干燥 |
| B、配制一定物质的量浓度的Fe(NO3)2溶液:将一定量的Fe(NO3)2溶于适量的硝酸中,再加入水稀释至指定浓度 |
| C、向足量饱和石灰水中加入少CaO,恢复至室温后溶液pH变大 |
| D、工业上分別用电解熔融Al2O3、MgO、NaCl的方法制取Al、Mg、Na |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (l)+H2(g)→
(l)+H2(g)→ (l)△H>0 ①
(l)△H>0 ① (l)+2H2(g)→
(l)+2H2(g)→ (l)△H<0 ②
(l)△H<0 ②| A、反应①、②都属于加成反应 |
| B、l,3一环己二烯比苯稳定 |
| C、反应①、②的热效应说明苯环中含有的并不是碳碳双键 |
| D、反应①、②中的所有有机物均可使溴水褪色,但褪色原理不完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
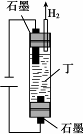 6种相邻短周期主族元素的相对位置如下表,M元素原子核外电子数是Y元素原子核外电子数的2倍,W元素原子的次外层电子数是最外层电子数的2倍.用化学用语回答下列问题:
6种相邻短周期主族元素的相对位置如下表,M元素原子核外电子数是Y元素原子核外电子数的2倍,W元素原子的次外层电子数是最外层电子数的2倍.用化学用语回答下列问题:| X | Y | Z | |
| W | M | Q |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(H+) |
| c(OH-) |
| c(H+) |
| c(HA) |
| c(HA) |
| c(A) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 K,Fe,C,N,O,S是中学化学常见的六种元素.
K,Fe,C,N,O,S是中学化学常见的六种元素.| 第一电离能 | 键的极性 | 熔点 | 稳定性 |
| N | H-S键 | 金刚石 | CH4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com