
 现有如下两个反应:A.Ca(OH)2+2NH4Cl═CaCl2+2NH3↑+2H2O B.Zn+H2SO4═ZnSO4+H2↑
现有如下两个反应:A.Ca(OH)2+2NH4Cl═CaCl2+2NH3↑+2H2O B.Zn+H2SO4═ZnSO4+H2↑分析 (1)根据常见的放热反应有:所有的物质燃烧、所有金属与酸反应、金属与水反应,所有中和反应;绝大多数化合反应和铝热反应;
常见的吸热反应有:绝大数分解反应,个别的化合反应(如C和CO2),少数分解置换以及某些复分解(如铵盐和强碱);
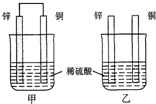
(2)①甲装置是原电池,铜极为正极发生还原反应,乙装置发生化学腐蚀,Zn表面产生气泡;
②甲装置是原电池,原电池的负极是锌失电子发生氧化反应,电极反应式为Zn-2e-=Zn2+;
③构成原电池的负极是锌失电子发生氧化反应,电极反应式为Zn-2e-=Zn2+,据此计算;
(3)为了加快乙的反应速率,可采用的措施有升温.增加浓度等.
解答 解:(1)A.Ca(OH)2+2NH4Cl═CaCl2+2NH3↑+2H2O 是吸热反应,故错误;
B.Zn+H2SO4═ZnSO4+H2↑为放热反应,故正确;故选:B;
(2)①甲装置是原电池,铜极为正极发生还原反应,乙装置发生化学腐蚀,Zn表面产生气泡,故答案为:还原;Zn;
②甲装置是原电池,原电池的负极是锌失电子发生氧化反应,电极反应式为Zn-2e-=Zn2+,故答案为:甲;Zn;
③构成原电池的负极是锌失电子发生氧化反应,电极反应式为Zn-2e-=Zn2+,所以若转移0.2mol电子,理论上Zn片质量减轻$\frac{0.2}{2}$×65g=6.5g,故答案为:6.5;
(3)为了加快乙的反应速率,可采用的措施有升温.增加浓度等,故答案为:升高温度.
点评 本题考查学生原电池的构成条件以及工作原理知识,属于综合知识的考查,难度不大.


 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温下是气体,易溶于水 | |
| B. | 甲烷的一氯取代物有一种,乙烷的一氯取代物有2种 | |
| C. | 在光照条件下能与Cl2发生取代反应 | |
| D. | 在空气中不能点燃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH与HCOOCH3 | |
| B. |  -OH与 -OH与 -CH2OH -CH2OH | |
| C. | CH3CH2CH2OH与CH${\;}_{{3}_{\;}}$CH2CH2CH2OH | |
| D. | CH3CH2CH2Br与CH3CH2CH2CH2Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2+、OH-、Al3+、NO3- | B. | H+、CO32-、[Al(OH)4]-、Na+ | ||
| C. | [Al(OH)4]-、OH-、Na+、Cl- | D. | Ba2+、Mg2+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
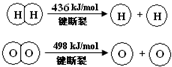
| A. | 该反应原理可用于设计氢氧燃料电池 | |
| B. | 破坏1 mol H-O键需要的能量是463.4 kJ | |
| C. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=+241.8 kJ/mol | |
| D. | H2(g)中的H-H键能比H2O(g)中的H-O键能大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | A的结构中含有碳碳双键 | |
| B. | G的同分异构体中属于酯且能发生银镜反应的只有一种 | |
| C. | 上述各物质中能发生水解反应的有A、B、D、G | |
| D. | 根据图示可推知D为苯酚 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com