
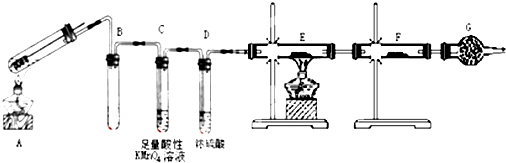
分析 加热条件下,铁和浓硫酸反应生成二氧化硫气体,稀硫酸和铁反应生成硫酸亚铁和氢气,二氧化硫能使品红溶液褪色,可以用品红溶液检验,且二氧化硫具有还原性,能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色;氢气具有还原性,能还原部分金属氧化物生成水,水可以用无水硫酸铜检验,根据元素守恒分析生成的气体中是否含有氢气;
(1)有缓冲装置的能防止倒吸;空气中含有水蒸气,能干扰水蒸气的检验;
(2)二氧化硫具有还原性,能将酸性高锰酸钾溶液还原而使其褪色;
(3)氢气具有还原性,能还原部分金属氧化物生成水蒸气,同时生成金属单质;
(4)亚铁离子具有还原性,能将酸性高锰酸钾溶液还原而使其褪色.
解答 解:加热条件下,铁和浓硫酸反应生成二氧化硫气体,稀硫酸和铁反应生成硫酸亚铁和氢气,二氧化硫能使品红溶液褪色,可以用品红溶液检验,且二氧化硫具有还原性,能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色;氢气具有还原性,能还原部分金属氧化物生成水,水可以用无水硫酸铜检验,根据元素守恒分析生成的气体中是否含有氢气;
(1)B装置有缓冲作用,能防止倒吸;气具有还原性,能还原部分金属氧化物生成水,水可以用无水硫酸铜检验,根据无水硫酸铜是否变色确定生成的气体中是否含有氢气,空气中含有水蒸气,能干扰实验,所以G的作用是吸收空气中水蒸气,防止干扰实验,
故答案为:防止倒吸;防止空气中的H2O进入F;
(2)二氧化硫具有还原性,能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,所以C中看到的现象是酸性高锰酸钾溶液颜色变浅,故答案为:酸性高锰酸钾溶液颜色变浅;
(3)氢气能还原黑色的氧化铜生成红色Cu,且生成的水蒸气能使无水硫酸铜由白色变为蓝色,如果E中黑色变为红色、F中白色粉末变为蓝色,根据元素守恒知,生成的气体中含有氢气;
如果去掉D装置,混合气体中可能含有水蒸气,从而干扰实验;
故答案为:E中黑色(CuO)变成红色(Cu),F中白色粉末变成蓝色;不能;因为混合气体中可能含H2O,会干扰H2的检验;
(4)亚铁离子具有还原性,能将酸性高锰酸钾溶液还原而使其褪色,其检验方法是:取A的溶液,滴加酸性高锰酸钾溶液,若红色褪去,证明有Fe2+,
故答案为:取A的溶液,滴加酸性高锰酸钾溶液,若红色褪去,证明有Fe2+.
点评 本题以浓硫酸和铁的反应为载体考查性质实验方案设计,明确实验原理是解本题关键,知道每个装置的作用,知道气体检验先后顺序,排除干扰因素,同时考查学生思维的缜密性及操作规范性,题目难度中等.


 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案科目:高中化学 来源: 题型:选择题
| A. | CH4 C2H4 C3H4 | B. | C2H6 C3H6 C4H6 | ||
| C. | CH4 C2H6 C3H8 | D. | C2H2 C2H4 CH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径按x、y、z顺序增大 | B. | 阴离子的还原性按x、y、z顺序增强 | ||
| C. | 单质的氧化性按x、y、z顺序增强 | D. | 氢化物的稳定性按x、y、z顺序减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Z)=0.45mol/L | B. | c(X2)=0.3mol/L c(Z)=0.1 mol/L | ||
| C. | c(X2)=0.5mol/L | D. | c(Y2)=0.5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
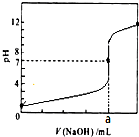 常温下,用0.1000mol/LNaOH溶液滴定20.00mL 0.1000mol/LHCl溶液,滴定曲线,如图所示.下列说法不正确的是( )
常温下,用0.1000mol/LNaOH溶液滴定20.00mL 0.1000mol/LHCl溶液,滴定曲线,如图所示.下列说法不正确的是( )| A. | a=20.00 | |
| B. | 滴定过程中,可能存在:c(Cl-)>c(H+)>c(Na+)>c(OH-) | |
| C. | 若用酚酞作指示剂,当滴定到溶液明显由无色变为红色时停止滴定 | |
| D. | 若将盐酸换成同浓度的醋酸,则滴定到pH=7时,a<20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
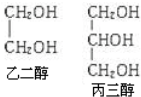
| A. | 某烷烃的名称为2-甲基-4-乙基戊烷 | |
| B. | 甲醇、乙二醇、丙三醇(结构如图)互为同系物 | |
| C. | 淀粉、纤维素、蔗糖都属于天然高分子化合物,而且水解产物中都有葡萄糖 | |
| D. | 等物质的量的乙烯与碳酸二甲酯(CH3OCOOCH3)完全燃烧耗氧量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com