
【题目】【2014全国大纲卷】化合物AX3和单质X2在一定条件下反应可生成化合物AX5。回答下列问题:
(1)已知AX3的熔点和沸点分别为-93.6 ℃和76 ℃,AX5的熔点为167 ℃。室温时AX3与气体X2反应生成lmol AX5,放出热量123.8 kJ。该反应的热化学方程式为 。
(2)反应AX3(g)+X2(g)![]() AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
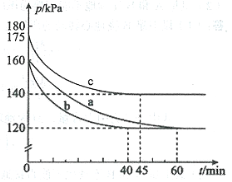
①列式计算实验a从反应开始至达到平衡时的反应速率 v(AX5)= 。
②图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为 (填实验序号);与实验a相比,其他两组改变的实验条件及判断依据是:b 、c 。
③用p0表示开始时总压强,p表示平衡时总压强,α表示AX3的平衡转化率,则α的表达式为 ;实验a和c的平衡转化率:αa为 、αc为 。
【答案】
(1)AX3(l)+X2(g) = AX5(s) ΔH=123.8KJ·mol-1
(2)
①![]()
②bca(2分)
b、加人催化剂。反应速率加快,但平衡点没有改变 (2分)
c、 温度升高。反应速率加快,但平衡点向逆反应方向移动(或反应容器的容积和起始物质的量未改变,但起始总压强增大)(2分)
③α=2(1-![]() ) (2分) 50% (1分) 40% (1分)
) (2分) 50% (1分) 40% (1分)
【解析】书写热化学方程式要分两步(第一步确定反应方程式并标出各物质的状态,第二步计算反应热,有的还应用盖斯定律);化学平衡图像分析时一定要从图中分析起点、转折点、终点等有用的数据,化学平衡的计算常用三段式进行分析、计算。
(1)据题意,先写出反应方程式并标出各物质的状态AX3(l)+X2(g) = AX5(s),然后确定其反应热ΔH=-123.8KJ·mol-1,综上便可写出完整的热化学方程式。
(2)①解:开始时no = 0.4 mol,总压强为160 kPa,平衡时总压强为120 kPa,
则n为:![]()
AX3(g) + X2(g) ![]() AX5(g)
AX5(g)
起始时no/mol: 0.20 0.20 0
平衡时n/mol:: 0.20 -x 0.20 -x x
(0.20-x)+(0.20-x)+x = 0.30
x = 0.10
![]()
②从图中观察平衡的时间(tb<tc<ta),判断反应速率的快慢为b>c>a;
b组的反应速率加快,但平衡点没有改变说明是加人了催化剂;
c组的反应速率加快,但平衡点向逆反应方向移动(或反应容器的容积和起始物质的量未改变,但起始总压强增大)说明是温度升高。
③用三段式分析:
AX3(g) + X2(g) ![]() AX5(g)
AX5(g)
起始时no/mol: 0.20 0.20 0
变化量n/mol:: 0.20α 0.20α 0.20α
平衡时n/mol:: 0.20 -0.20α 0.20 -0.20α 0.20α
据题意有![]() ,化简得α=2(1-
,化简得α=2(1-![]() );
);
将图中p0、p的数据代入上述计算式得αa=2(1-![]() )=2(1-
)=2(1-![]() )=50%;
)=50%;
αc=2(1-![]() )=2(1-
)=2(1-![]() )=40%。
)=40%。


 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数,下列说法正确的是( )
A. 0.5 molAl与足量盐酸反应转移电子数为1NA
B. 标准状况下,11.2L SO3所含的分子数为0.5NA
C. 0.1molCH4所含的电子数为1NA
D. 46gNO2和N2O4的混合物含有的分子数为1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于现行的元素周期表的说法正确的是( )
A.短周期是指第一、二周期
B.IA族的元素全部是金属元素
C.元素周期表有8个副族
D.元素周期表有18个纵行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016年浙江卷】催化还原CO2是解决温室效应及能源问题的重要手段之一。研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO。反应的热化学方程式如下:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)ΔH1=-53.7kJ·mol-1I
CH3OH(g)+H2O(g)ΔH1=-53.7kJ·mol-1I
CO2(g)+H2(g)![]() CO(g)+H2O(g)ΔH2II
CO(g)+H2O(g)ΔH2II
某实验室控制CO2和H2初始投料比为1:2.2,在相同压强下,经过相同反应时间测得如下实验数据:

【备注】Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醇的百分比
已知:①CO和H2的标准燃烧热分别为-283.0kJ·mol-1和-285.8kJ·mol-1
②H2O(l)![]() H2O(g)ΔH3=44.0kJ·mol-1
H2O(g)ΔH3=44.0kJ·mol-1
请回答(不考虑温度对ΔH的影响):
(1)反应I的平衡常数表达式K=;反应II的ΔH2=kJ·mol-1。
(2)有利于提高CO2转化为CH3OH平衡转化率的措施有。
A.使用催化剂Cat.1
B.使用催化剂Cat.2
C.降低反应温度
D.投料比不变,增加反应物的浓度
E.增大CO2和H2的初始投料比
(3)表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是。
(4)在图中分别画出反应I在无催化剂、有Cat.1和有Cat.2三种情况下“反应过程~能量”示意图。

(5)研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在极,该电极反应式是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016上海卷】随着科学技术的发展和环保要求的不断提高,CO2的捕集利用技术成为研究的重点。
完成下列填空:
(1)目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:
CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
已知H2的体积分数随温度升高而增加。
若温度从300℃升至400℃,重新达到平衡,判断下列表格中各物理量的变化。(选填“增大”、“减小”或“不变”)
v正 | v逆 | 平衡常数K | 转化率α |
(2)相同温度时,上述反应在不同起始浓度下分别达到平衡,各物质的平衡浓度如下表:
[CO2]/mol·L-1 | [H2]/mol·L-1 | [CH4]/mol·L-1 | [H2O]/mol·L-1 | |
平衡Ⅰ | a | b | c | d |
平衡Ⅱ | m | n | x | y |
a、b、c、d与m、n、x、y之间的关系式为_________。
(3)碳酸:H2CO3,Ki1=4.3×10-7,Ki2=5.6×10-11
草酸:H
0.1 mol/L Na2CO3溶液的pH____________0.1 mol/L Na2C2O4溶液的pH。(选填“大于”、“小于”或“等于”)
等浓度的草酸溶液和碳酸溶液中,氢离子浓度较大的是___________。
若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子浓度大小的顺序正确的是_____。(选填编号)
a.[H+]>[HC2O4-]>[HCO3-]>[CO32-]
B.[HCO3-]>[HC2O4-]>[C2O42-]>[CO32-]
c.[H+]>[HC2O4-]>[C2O42-]>[CO32-]
D.[H2CO3] >[HCO3-]>[HC2O4-]>[CO32-]
(4)人体血液中的碳酸和碳酸氢盐存在平衡:H++ HCO3-![]() H2CO3,当有少量酸性或碱性物质进入血液中时,血液的pH变化不大,用平衡移动原理解释上述现象。_______________________
H2CO3,当有少量酸性或碱性物质进入血液中时,血液的pH变化不大,用平衡移动原理解释上述现象。_______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. CO2的沸点低于SiO2,其原因是分子间作用力:CO2<SiO2
B. H2SO4溶于水能电离出H+和SO42-,所以硫酸是离子化合物
C. PCl5中,每个原子的最外层都具有8电子稳定结构
D. 离子化合物中不一定含有金属元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com