
| A. | 上述各反应均既属于氧化还原反应,有属于离子反应 | |
| B. | 氧化性:KMnO4>K2Cr2O7>Cl2>MnO2 | |
| C. | 盐酸的浓度越大,Cl-的还原性越强 | |
| D. | 每生成1molCl2,上述各反应转移的电子数均为2NA(NA为阿伏加德罗常数的值) |
分析 A.化学反应中有元素化合价变化的属于氧化还原反应,有离子参加的化学反应是离子反应;
B.在自发进行的氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性;
C.盐酸的浓度越大,氯离子的还原性越强;
D.根据化合价变化判断.
解答 解:A.这三个分子中都有元素化合价变化,且都有离子参加,所以既属于氧化还原反应又属于离子反应,故A正确;
B.MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O中二氧化锰的氧化性大于氯气,故B错误;
C.盐酸的浓度越大,氯离子的浓度越大,其反应速率越快,则氯离子的还原性越强,故C正确;
D.生成1 mol Cl2转移电子数均为2[0-(-1)]NA=2 NA,故D正确
故选B.
点评 本题考查氧化还原反应,明确氧化还原反应的实质是解本题关键,难度不大.


 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:解答题
 氯碱工业中电解饱和食盐水的原理示意图如图所示:
氯碱工业中电解饱和食盐水的原理示意图如图所示:查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上第一次月考化学卷(解析版) 题型:填空题
用Cl2生产某些含氯有机物时会产生副产物HC1。利用 反应A,可实现氯的循环利用。
反应A,可实现氯的循环利用。
反应A:4HCl+O22Cl2+2H2O
(1)已知:Ⅰ、反应A中, 4mol HCl被氧化,放出115.6kJ的热量。
4mol HCl被氧化,放出115.6kJ的热量。
Ⅱ、
①反应A的热化学方程式是________________________。
②断开1 mol H—O 键与断开 1 mol H—Cl 键所需能量相差约为__________kJ,H2O中H—0 键比HCl中H—Cl键(填“强”或“弱”)_______________。
(2)合成氨工厂常通过测定反应前后混合气体的密度来确定氨的转化率。某工厂测得合成塔中N2、H2混合气体的密度为0.5536g/L(标准状况),从合成塔中出来的混合气体在相同条件下密度为0.693g/L(标准状况)。该合成氨厂N2的转化率为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

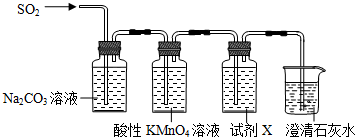
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 生成等量的CuSO4时,②消耗的酸最少,且能体现绿色化学思想 | |
| B. | 反应⑥中Y可以是葡萄糖或乙醛溶液 | |
| C. | 反应④所得混合气体X中一定有O2 | |
| D. | 反应①中H2SO4与HNO3物质的量最佳比为3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q1>Q2 | B. | Q1=Q2 | C. | 2Q1>Q2 | D. | Q2=Q1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
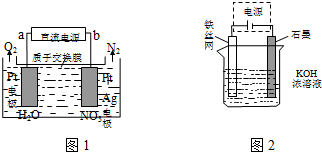 (一)发生在天津港“8•12”特大火灾爆炸事故,再一次引发了人们对环境问题的关注.
(一)发生在天津港“8•12”特大火灾爆炸事故,再一次引发了人们对环境问题的关注.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.2 g | B. | 4.8 g | C. | 5.4 g | D. | 3.8 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com