
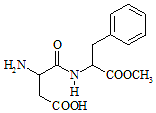
 阿斯巴甜(Aspartame,结构简式如图所示)具有清爽的甜味,甜度约为蔗糖的200倍.下列有关说法正确的是( )
阿斯巴甜(Aspartame,结构简式如图所示)具有清爽的甜味,甜度约为蔗糖的200倍.下列有关说法正确的是( )| A. | 分子式为C14H18N2O3,阿斯巴甜不属于蛋白质 | |
| B. | 阿斯巴甜的水解产物中只有一种氨基酸 | |
| C. | 阿斯巴甜在一定条件下不能与酸反应、只能与碱反应 | |
| D. | 阿斯巴甜分子中有3个手性碳原子 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
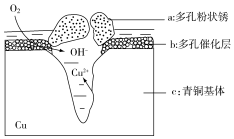 青铜器的制造是中华民族劳动人民智慧的结晶,成为一个时代的象征,但出土的青铜器大多受到环境腐蚀.如图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.环境中的 Cl- 扩散到孔口,并与各电极产物作用生成多孔粉状锈 Cu2(OH)3Cl.下列说法不正确的是( )
青铜器的制造是中华民族劳动人民智慧的结晶,成为一个时代的象征,但出土的青铜器大多受到环境腐蚀.如图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图.环境中的 Cl- 扩散到孔口,并与各电极产物作用生成多孔粉状锈 Cu2(OH)3Cl.下列说法不正确的是( )| A. | 腐蚀过程中,负极c被氧化 | |
| B. | 环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为2Cu2++3OH-+Cl-═Cu2(OH)3Cl↓ | |
| C. | 若生成 2.145 g Cu2(OH)3Cl,则理论上消耗标准状况氧气体积为 0.448 L | |
| D. | 正极的电极反应式为:O2+4e-+2H2O═4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将Cl2通入氢氧化钠溶液制取消毒液:C12+2OH-═Cl-+ClO-+H2O | |
| B. | 己知亚硫酸(H2SO3)的二级电离常数K2比偏铝酸(HAlO2)的电离常数K要大,则将少量的SO2气体通入到偏铝酸钠溶液中发生的离子反应是:2AlO2-+SO2+3 H2O═2 Al(OH)3↓+SO32- | |
| C. | 在明矾溶液中加入氢氧化钡溶液至沉淀的质量达到最大时发生的离子反应是:2Al3++3SO42-+3Ba2++6OH-═3BaSO4↓+2 Al(OH)3↓ | |
| D. | 利用酸性高锰酸钾测居室中甲醛含量反应为:4MnO4-+5HCHO+12H+═4Mn2++5CO2↑+11H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属的熔点和沸点都很高 | B. | CCl4是含有极性键的非极性分子 | ||
| C. | HF、HCl、HBr、HI的稳定性依次增强 | D. | 第一电离能N<O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
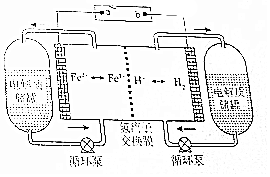 H2-Fe3+/Fe2+氧化还原液流电池是一种新型氧化还原液流电池,电池的结构如图所示,电解质溶液为1 mol/L H2SO4和0.5 mol/L Fe2(SO4)3的混合液.下列说法正确的是( )
H2-Fe3+/Fe2+氧化还原液流电池是一种新型氧化还原液流电池,电池的结构如图所示,电解质溶液为1 mol/L H2SO4和0.5 mol/L Fe2(SO4)3的混合液.下列说法正确的是( )| A. | 充电时,a连接直流电源的正极 | |
| B. | 充电时,阴极的电极反应式为2Fe3++2e-═2Fe2+ | |
| C. | 放电时,右侧电解质储罐中的SO42-浓度逐渐增加 | |
| D. | 放电时,当转移0.1mol e-时,透过交换膜的离子有0.2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当a≥b时,发生的离子反应为SO32-+Cl2+H2O=SO42-+2H++2Cl- | |
| B. | 当5a=4b时,发生的离子反应为4SO32-+2I-+5Cl2+4H2O=4SO42-+I2+8H++10Cl- | |
| C. | 当a≤b≤$\frac{3}{2}$a时,反应中转移电子的物质的量n(e-)为a mol≤n(e-)≤3a mol | |
| D. | 当a<b<$\frac{3}{2}$a时,溶液中SO42-、I-与Cl-的物质的量之比为a:(3a-2b):2b |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com