
分析 根据相对氢气密度可以计算有机物A的相对分子质量,氯化钙增重为燃烧生成水的质量,计算有机物A以及燃烧生成二氧化碳、水的物质的量,根据原子守恒计算分子中C、H原子数目,结合相对分子质量计算O原子数目,进而确定有机物分子式;
1mol该有机物可以和NaHCO3溶液反应放出2mol气体,说明有机物分子含有4个羧基,且其核磁共振氢谱图有3组峰,峰面积比为2:2:1,结合分子式确定可能的结构简式.
解答 解:(1)有机物A的相对分子质量为73×2=146,7.3g有机物A的物质的量为$\frac{7.3g}{146g/mol}$=0.05mol,
燃烧生成二氧化碳为$\frac{6.72L}{22.4L/mol}$=0.3mol,则分子中C原子数目为$\frac{0.3mol}{0.05mol}$=6,
燃烧生成水为$\frac{4.5g}{18g/mol}$=0.25mol,则有机物分子中H原子数目为$\frac{0.25mol×2}{0.05mol}$=10,
则有机物分子中O原子数目为$\frac{146-12×6-10}{16}$=4,
故有机物分子式为C6H10O4,
答:有机物分子式为C6H10O4;
(2)1mol该有机物可以和NaHCO3溶液反应放出2mol气体,说明有机物分子含有2个羧基,且其核磁共振氢谱图有3组峰,峰面积比为2:2:1,则A的结构简式为HOOCCH2CH2CH2CH2COOH,
答:A的结构简式为HOOCCH2CH2CH2CH2COOH;
(3)A与乙二醇通过缩聚反应生成高分子化合物,该反应方程式为:n HOOCCH2CH2CH2CH2COOH+n HOCH2CH2OH$→_{△}^{浓硫酸}$ +(2n-1)H2O,
+(2n-1)H2O,
故答案为:n HOOCCH2CH2CH2CH2COOH+n HOCH2CH2OH$→_{△}^{浓硫酸}$ +(2n-1)H2O.
+(2n-1)H2O.
点评 本题考查有机物的推断,关键是掌握官能团的性质与转化,侧重考查学生分析推理能力与知识迁移运用能力,掌握燃烧法利用原子守恒确定有机物分子式.


科目:高中化学 来源: 题型:选择题
| A. | pH=1的硝酸溶液加水稀释,水的电离平衡向右移动 | |
| B. | 合成氨工作中使用铁触媒作催化剂 | |
| C. | 饱和FeCl3溶液滴入沸水中可制得氢氧化铁胶体 | |
| D. | 热的纯碱溶液去油污效果好 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 分子式/结构式 | NO/N≡O | CO/C≡O | CO2/O≡C=O | N2/N≡N |
| 化学键 | N≡O | C≡O | C≡O | N≡N |
| 键能(kJ/mol) | 632 | 1072 | 750 | 946 |
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/×10-2mol | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| n(NO)/×10-1mol | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 存在 2,2-二甲基-3-戊炔 | |
| B. | 月桂烯分子中( 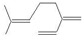 )所有碳原子一定在同一平面上 )所有碳原子一定在同一平面上 | |
| C. | CF2Cl2存在两种同分异构体 | |
| D. | 用红外光谱法可鉴别二甲醚和乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 酚酞不能用作本实验的指示剂 | |
| B. | 盐酸的物质的量浓度为1mol?L-1 | |
| C. | P点时恰好完全中和,溶液呈中性 | |
| D. | 曲线a是盐酸滴定氢氧化钠溶液的滴定曲线 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸与烧碱混合:H++OH-═H2O | |
| B. | 大理石中加入盐酸:CO32-+2H+═CO2↑+H2O | |
| C. | 稀硫酸滴在铁片上:Fe+2H+═Fe2++H2↑ | |
| D. | 硫酸铜溶液和氢氧化钡溶液混合:Cu2++2OH-═Cu(OH)2↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com