

| A. | 甲装置:可用来证明硫的非金属性比硅强 | |
| B. | 乙装置:用盐酸标准液测氢氧化钠溶液浓度 | |
| C. | 丙装置:配制一定物质的量浓度的氢氧化钠溶液 | |
| D. | 丁装置:可在瓶中先装满水,气体由②口入,收集NO气体 |
分析 A.元素最高价氧化物的水化物酸性越强,其非金属的非金属性越强,强酸能和弱酸的盐反应生成弱酸;
B.盐酸应放入酸式滴定管中;
C.不能在容量瓶中稀释溶解氢氧化钠;
D.NO不溶于水,可以采用排水法收集.
解答 解:A.二氧化硫和水反应生成亚硫酸,亚硫酸酸性大于硅酸,所以二氧化硫能和硅酸钠反应生成硅酸,但亚硫酸不是S元素最高价氧化物的水化物,所以不能据此判断S、Si的非金属性强弱,故A错误;
B.盐酸应放入酸式滴定管中,故B错误;
C.容量瓶只能用于配制一定浓度的溶液,不能在容量瓶中稀释溶解氢氧化钠;
D.NO不溶于水,可以采用排水法收集,如果该集气瓶中装满水,导气管遵循“短进长出”原则,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握实验原理及实验装置的作用为解答的关键,明确实验基本操作和物质的性质即可解答,注意实验的评价性和操作性分析,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 向硫酸钡沉淀中加入浓碳酸钠溶液充分搅拌后,取沉淀(洗净)放入盐酸中有气泡产生,说明Ksp(BaCO3)<Ksp(BaSO4) | |
| B. | 向淀粉溶液中加入稀硫酸并加热片刻,然后再加入适量银氨溶液进行水浴加热,没有银镜生成,说明淀粉没有水解 | |
| C. | 将二氧化硫气体通入到高锰酸钾酸性溶液中,溶液紫红色褪去,说明二氧化硫有漂白性 | |
| D. | 向碳酸钠溶液中滴加几滴酚酞试液,然后再加入氯化钡溶液,溶液红色褪去,说明碳酸钠溶液中存在水解平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
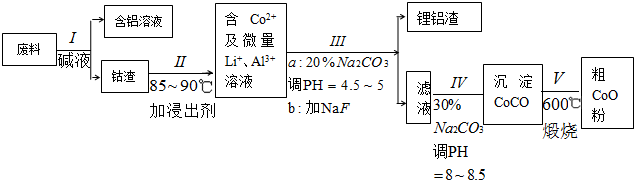
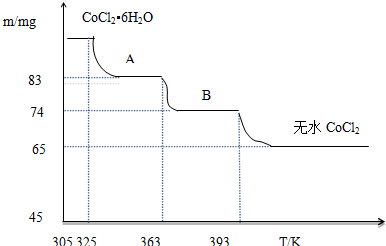
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和10mL0.1mol•L-1HAc与中和100mL0.01mol•L-1HAc所需NaOH的物质的量不同 | |
| B. | 10mL0.1mol•L-1氨水与100mL0.01mol•L-1氨水,其OH-物质的量相同 | |
| C. | 相同条件下,将pH值相同的盐酸和醋酸稀释相同的倍数,盐酸pH值变化较大 | |
| D. | 锌分别与pH=3的盐酸和pH=3的醋酸溶液反应,起始反应速率盐酸较快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乳酸:CH3-CHOH-COOH | |
| B. | 甘油:CH2OH-CHOH-CH2OH | |
| C. | 脱氧核糖:CH2OH-CHOH-CHOH-CH2-CHO | |
| D. | 核糖:CH2OH-CHOH-CHOH-CHOH-CHO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | ||
| D | E | F | G |
| A. | G的最高价氧化物对应的水化物是最强的酸 | |
| B. | 熔融电解化合物D2C3可制取单质D | |
| C. | F的最高价含氧酸的浓溶液与单质A共热时能生成三种氧化物 | |
| D. | A、G分别与氢元素形成的化合物中,化学键均为极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;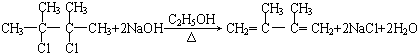 ;C的化学名称为2,3-二甲基-1,3-丁二烯.
;C的化学名称为2,3-二甲基-1,3-丁二烯.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com