
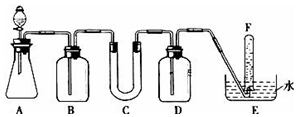
 在呼吸面具和潜水艇中可用过氧化钠作为供氧剂.请选用适当的化学试剂和实验用品.用图中的实验装置进行实验,证明过氧化钠可作供氧剂.
在呼吸面具和潜水艇中可用过氧化钠作为供氧剂.请选用适当的化学试剂和实验用品.用图中的实验装置进行实验,证明过氧化钠可作供氧剂.| 仪器 | 加入试剂 | 加入该试剂的目的 |
| B | 饱和NaHCO3溶液 | 除去CO2气体中混入的HCl |
| C | 石棉绒与过氧化钠 | 与CO2反应,产生O2 |
| D | NaOH溶液 | 吸收未反应的CO2气体 |
分析 由实验装置可知,本实验首先由CaCO3和盐酸反应生成CO2,产生气体通过饱和NaHCO3溶液,以除去CO2气体中混入的HCl,然后过氧化钠与CO2和水蒸气反应,产生O2,用排水法收集O2,最后取出试管,立即把带火星的木条伸入试管口内,木条复燃,证明试管中收集的气体是氧气.
解答 解:(1)产生气体通过饱和NaHCO3溶液,以除去CO2气体中混入的HCl,然后过氧化钠与CO2和水蒸气反应,产生O2,由于生成的氧气中混有二氧化碳气体,应用NaOH溶液洗气,吸收未反应的CO2气体,用排水法收集O2,
故答案为:
| 仪器 | 加入试剂 | 加入该试剂的目的 |
| B | NaHCO3 | 除去CO2气体中混入的HCl |
| C | 过氧化钠 | |
| D | NaOH溶液 | 吸收未反应的CO2气体 |
点评 本题考查过氧化钠的性质的实验设计,题目难度不大,解答本题注意把握实验原理和相关实验的基本操作,注意除杂的先后顺序和检验氧气的操作方法.


 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 将250g CuSO4•5H2O溶解在1L水中 | |
| B. | 将22.4L HCl气体溶于水配成1L溶液 | |
| C. | 将1L10mol•L-1的浓盐酸加入9L水中 | |
| D. | 将10g NaOH溶解在少量水中,再加蒸馏水直到溶液体积为250mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②④ | C. | ③⑤ | D. | ④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol?L-1的MgCl2溶液中含Cl-的数目为0.2NA | |
| B. | 100g质量分数为46%的乙醇水溶液中氧原子数为4 NA | |
| C. | 标准状况下,11.2 L CCl4中含C-Cl键的数目为2NA | |
| D. | 20 ml 2mol?L-1 H2O2完全分解,转移的电子数为0.08NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2S的电离方程式:H2S+H2O?H3O++HS- | |
| B. | NaHCO3在水溶液中的电离方程式:NaHCO3=Na++H++CO32- | |
| C. | CO32-的水解方程式:CO32-+2H2O?H2CO3+2OH- | |
| D. | HS-的水解方程式:HS-+H2O?S2-+H3O+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| B. | 转化关系Na→Na2O→Na2O2中,钠元素被连续氧化 | |
| C. | SO2通入BaCl2溶液中无沉淀产生,通入Ba(NO3)2溶液中有沉淀产生 | |
| D. | 棉布、羊毛和涤纶燃烧后都只生成二氧化碳和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 验证牺牲阳极的阴极保护法(Fe电极、烧杯、K3[Fe(CN)6]溶液) | |
| B. | 铝热反应(漏斗、KClO3、铝粉) | |
| C. | 探究温度对化学平衡的影响(温度计、NO2球、烧杯) | |
| D. | 制氢氧化铁胶体(饱和FeCl3溶液、玻璃棒、胶头滴管) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液 | |
| B. | 将Fe(NO3)2样品溶于稀盐酸中,然后滴加KSCN溶液,溶液变红,说明Fe(NO3)2样品已氧化变质 | |
| C. | 在食盐试样中加入盐酸和KI溶液,加入淀粉溶液后变蓝,说明食盐试样中可能含有KIO3 | |
| D. | 加入AgNO3溶液后生成白色沉淀,加稀盐酸沉淀不溶解时,可确定有Cl-存在 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com