
【题目】某无色溶液中可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 这几种离子中的若干种,依次进行下列实验,观察到的现象记录如下:①
这几种离子中的若干种,依次进行下列实验,观察到的现象记录如下:①![]() 试纸检验,溶液的
试纸检验,溶液的![]() ②取少量原溶液,向溶液中加入过量的
②取少量原溶液,向溶液中加入过量的![]() 和盐酸的混合溶液,无白色沉淀生成③另取少量原溶液,向溶液中滴加足量氯水、无气体产生,再加入
和盐酸的混合溶液,无白色沉淀生成③另取少量原溶液,向溶液中滴加足量氯水、无气体产生,再加入![]() 振荡,静置后
振荡,静置后![]() 层呈橙色,用分液漏斗分液④向分液后的水溶液中加入
层呈橙色,用分液漏斗分液④向分液后的水溶液中加入![]() 和
和![]() 溶液,有白色沉淀产生⑤在滤液中加入
溶液,有白色沉淀产生⑤在滤液中加入![]() 和
和![]() 的混合溶液有白色沉淀产生。则关于原溶液的判断中正确的是
的混合溶液有白色沉淀产生。则关于原溶液的判断中正确的是
A.肯定不存在的离子是![]() 、
、![]() 、
、![]() 、
、![]()
B.肯定存在的离子是![]() 、
、![]() 、
、![]()
C.无法确定原溶液中是否存在![]() 和
和![]()
D.若步骤④改用![]() 和盐酸的混合溶液,则对溶液中离子的判断也无影响
和盐酸的混合溶液,则对溶液中离子的判断也无影响
【答案】D
【解析】
无色溶液中一定不存在有色离子:![]() 、
、![]() ;
;
![]() 试纸检验,溶液呈碱性,说明溶液中存在弱酸根离子
试纸检验,溶液呈碱性,说明溶液中存在弱酸根离子![]() 或
或![]() ;
;
![]() 取少量原溶液,向溶液中加入过量的
取少量原溶液,向溶液中加入过量的![]() 和盐酸的混合溶液,无白色沉淀生成,硫酸钡不溶于盐酸,说明溶液中一定不存在
和盐酸的混合溶液,无白色沉淀生成,硫酸钡不溶于盐酸,说明溶液中一定不存在![]() ;
;
![]() 另取少量原溶液,向溶液中滴加足量氯水,无气体产生,说明没有
另取少量原溶液,向溶液中滴加足量氯水,无气体产生,说明没有![]() ,再加入
,再加入![]() 振荡,静置后
振荡,静置后![]() 层呈橙红色,橙色物质为溴单质,说明溶液中一定存在
层呈橙红色,橙色物质为溴单质,说明溶液中一定存在![]() ;
;
![]() 用分液漏斗分液,取上层溶液,加入
用分液漏斗分液,取上层溶液,加入![]() 和
和![]() 溶液有白色沉淀产生,说明有硫酸钡生成,即含有
溶液有白色沉淀产生,说明有硫酸钡生成,即含有![]() ,
,
![]() 在滤液中加入
在滤液中加入![]() 和
和![]() 的混合溶液有白色沉淀产生,由于
的混合溶液有白色沉淀产生,由于![]() 加入氯水引进了氯离子,无法证明原溶液中是否存在氯离子;
加入氯水引进了氯离子,无法证明原溶液中是否存在氯离子;
由电荷守恒可知溶液中还一定含有![]() ;
;
根据以上分析可知,原溶液中一定存在的离子为:![]() 、
、![]() 、
、![]() ,一定不存在的离子为:
,一定不存在的离子为:![]() 、
、![]() 、
、![]() 、
、![]() ,无法确定的离子为:
,无法确定的离子为:![]() ,
,
A.根据分析可知,溶液中一定不存在的离子为:![]() 、
、![]() 、
、![]() 、
、![]() ,一定含有
,一定含有![]() 、
、![]() 、
、![]() ,故A错误;
,故A错误;
B.原溶液中一定不存在![]() ,故B错误;
,故B错误;
C.根据分析可知,溶液中一定不存在![]() ,故C错误;
,故C错误;
D.若步骤![]() 目的是检验是否含有
目的是检验是否含有![]() ,改用
,改用![]() 和盐酸的混合溶液,则对溶液中离子的判断也无影响,故D正确;
和盐酸的混合溶液,则对溶液中离子的判断也无影响,故D正确;
故答案为D。


科目:高中化学 来源: 题型:
【题目】已知反应:2NO(g)+Br2(g)![]() 2NOBr(g) △H=-a kJ·mol-1 (a>0),其反应机理如下
2NOBr(g) △H=-a kJ·mol-1 (a>0),其反应机理如下
①NO(g)+Br2(g)![]() NOBr2(g) 快 ②NO(g)+NOBr2(g)
NOBr2(g) 快 ②NO(g)+NOBr2(g)![]() 2NOBr(g) 慢
2NOBr(g) 慢
下列有关该反应的说法正确的是( )
A. 该反应的速率主要取决于①的快慢
B. NOBr2是该反应的催化剂
C. 正反应的活化能比逆反应的活化能小a kJ·mol-1
D. 增大Br2(g)浓度能增大活化分子百分数, 加快反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氨氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K1 ΔH1<0(Ⅰ)
NaNO3(s)+ClNO(g) K1 ΔH1<0(Ⅰ)
2NO(g)+Cl2(g)![]() 2ClNO(g) K2 ΔH2<0(Ⅱ)
2ClNO(g) K2 ΔH2<0(Ⅱ)
(1)4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=_______(用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=_______(用K1、K2表示)。
(2)为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向2 L恒容密闭容器中加入0.2 mol NO和0.1 mol Cl2,10 min时反应(Ⅱ)达到平衡。测得10 min内v(ClNO)=7.5×10-3 mol·L-1·min-1,则平衡后n(Cl2)=________mol,NO的转化率α1=________。其他条件保持不变,反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率α2________α1(填“>”“<”或“=”),平衡常数K2______(填“增大”“减小”或“不变”)。若要使K2减小,可采取的措施是________。
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH===NaNO3+NaNO2+H2O。含0.2 mol NaOH的水溶液与0.2 mol NO2恰好完全反应得1 L溶液A,溶液B为0.1 mol·L-1的CH3COONa溶液,则两溶液中c(NO![]() )、c(NO
)、c(NO![]() )和c(CH3COO-)由大到小的顺序为______________________________。(已知HNO2电离常数Ka=7.1×10-4 mol·L-1,CH3COOH的电离常数Ka=1.7×10-5 mol·L-1)可使溶液A和溶液B的pH相等的方法是________。
)和c(CH3COO-)由大到小的顺序为______________________________。(已知HNO2电离常数Ka=7.1×10-4 mol·L-1,CH3COOH的电离常数Ka=1.7×10-5 mol·L-1)可使溶液A和溶液B的pH相等的方法是________。
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作、现象和结论都正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 向稀硝酸中加入过量的铁粉充分反应后,滴入KSCN溶液 | 溶液变为血红色 |
|
B | 向盛有某溶液的试管中滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口 | 试纸颜色无明显变化 | 原溶液中无 |
C | 向淀粉溶液中加入稀硫酸,加热,冷却后加入新制 | 未见红色沉淀 | 淀粉未发生水解 |
D | 向含有酚酞的 | 溶液红色变浅 | 证明 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于0.1mol/L Na2CO3溶液,下列判断不正确的是
A.粒子种类与NaHCO3溶液相同
B.升高温度,c(CO32-)增大
C.加入CaCl2溶液,c(CO32-)减小
D.c(H+)+c(Na+)=2c(CO32-)+c(HCO3-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M是合成药物胃长宁的重要中间体,其典型的合成路线如下:
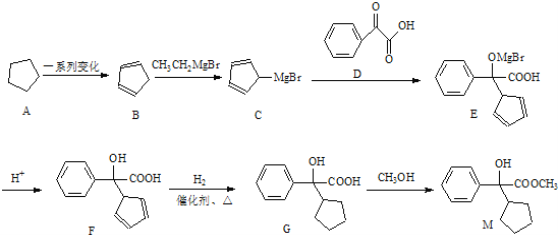
请回答下列问题:
(1)化合物M的分子式是________;
(2)C→E的反应类型是_____,化合物F中含氧官能团的名称为__________;
(3)下列有关化合物F的说法正确的是___________(用相应编号填写)
A.不能发生消去反应
B.核磁共振氢谱有7组峰
C.能使溴水褪色,并发生加成反应
D.在一定条件下能聚合成高分子化合物,其链节为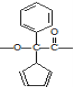
(4)写出G→M发生的化学反应方程式 _____________________________。
(5)化合物D有多种同分异构体,写出两种符合下列条件的同分异构体的结构简式____________________。
①属于芳香族化合物,且其苯环上的一氯取代物有2种
②能发生银镜反应 ③能与FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质的电导率越大,导电能力越强。用0.100mol·L-1的KOH溶液分别滴定体积均为20.00mL、浓度均为0.100molL-1的盐酸和CH3COOH溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是( )

A. 曲线②代表滴定CH3COOH溶液的曲线
B. 在相同温度下,P点水电离程度大于M点
C. M点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.1mol·L-1
D. N点溶液中:c(K+)>c(OH-)>c(CH3COO-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可降解高分子材料P的结构为: 。如图是P的合成路线。
。如图是P的合成路线。

已知:![]() +R3OH
+R3OH![]() +R2OH。
+R2OH。
(1)B的结构简式是_______,试剂a是_______。
(2)③的化学方程式是______。
(3)G与E互为同分异构体,符合下列要求的G共有______种。(不考虑立体异构)①含有和E(C6H10O3)相同的含氧官能团②分子中含有六元环状内酯结构
(4)当④中反应物以物质的量之比1:1发生反应时,反应⑤的化学方程式是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米级Cu2O由于具有优良的催化性能而受到关注。采用离子交换膜控制电解液中OH一的浓度制备纳米级Cu2O的装置如图所示,发生的反应为:2Cu+H2O![]() Cu2O+H2↑。下列说法正确的是
Cu2O+H2↑。下列说法正确的是

A.钛电极发生氧化反应
B.阳极附近溶液的pH逐渐增大
C.离子交换膜应采用阳离子离子交换膜
D.阳极反应式是:2Cu+2OH一一2e一== Cu2O+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com