
| A. | 质子数:c>d | B. | 氢化物的稳定性:H2Y>HZ | ||
| C. | 离子的氧化性:X+<W3+ | D. | 原子半径:X<W |
分析 元素周期表前三周期元素的离子aW3+、bX+、cY2-、dZ-具有相同电子层结构,核外电子数相等,所以a-3=b-1=c+2=d+1,Y、Z为非金属,应处于第二周期,故Y为O元素,Z为F元素,W、X为金属应处于第三周期,W为Al元素,X为Na元素,以此解答该题.
解答 解:元素周期表前三周期元素的离子aW3+、bX+、cY2-、dZ-具有相同电子层结构,核外电子数相等,所以a-3=b-1=c+2=d+1,Y、Z为非金属,应处于第二周期,故Y为O元素,Z为F元素,W、X为金属应处于第三周期,W为Al元素,X为Na元素,
A.离子的电子层结构相同,则c+2=d+1,则质子数d>c,故A错误;
B.非金属性越强,其氢化物的稳定性越强,非金属性Y<Z,则氢化物的稳定性H2Y<HZ,故B错误;
C.元素的金属性越强,其阳离子的氧化性越弱,金属性Na>Al,则离子的氧化性:X+<W3+,故C正确;
D.W是Al元素、X是Na元素,同一周期元素,原子半径随着原子序数增大而减小,所以原子半径W<X,故D错误;
故选C.
点评 本题考查原子结构和元素性质,正确判断元素是解本题关键,熟练掌握同一周期、同一主族元素原子结构、元素性质递变规律,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,
, ,稳定性较好.
,稳定性较好.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y、Z、W四种元素的简单氢化物中,Y的气态氢化物最稳定 | |
| B. | Y、Z、W四种元素的原子半径由大到小的顺序为:Y>Z>W | |
| C. | X、Z和W三种元素形成的简单离子的半径由大到小的顺序为:W>Z>X | |
| D. | Y、Z和W三种元素的最高价氧化物对应的水化物都是强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
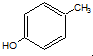 对甲基苯酚与溴水反应
对甲基苯酚与溴水反应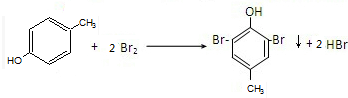
 环已二烯与氯气1,4加成
环已二烯与氯气1,4加成 +Cl2$\stackrel{催化剂}{→}$
+Cl2$\stackrel{催化剂}{→}$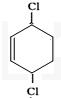
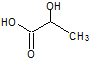 乳酸自酯化生成六元环状有机物CH3CH(OH)COOH$→_{△}^{浓硫酸}$
乳酸自酯化生成六元环状有机物CH3CH(OH)COOH$→_{△}^{浓硫酸}$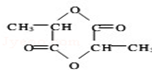 +2H2O
+2H2O .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
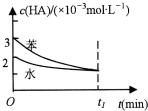 常温下,将一定量的一元有机弱酸:HA加入到100mL水与100mL苯的混合体系中,HA在水中部分电离:HA?H++A-,在苯中则部分发生双聚反应:2HA?(HA)2.在水和苯中,HA的起始浓度及平衡浓度关系如图所示.下列有关该混合体系说法正确的是( )
常温下,将一定量的一元有机弱酸:HA加入到100mL水与100mL苯的混合体系中,HA在水中部分电离:HA?H++A-,在苯中则部分发生双聚反应:2HA?(HA)2.在水和苯中,HA的起始浓度及平衡浓度关系如图所示.下列有关该混合体系说法正确的是( )| A. | HA在水中的电离速率大于其在苯中的双聚速率 | |
| B. | t1时刻在水中和苯中c(A-)相同 | |
| C. | 向上述的混合体系中加入少量水和苯的混合物,则两平衡均正移,c(HA)均减小 | |
| D. | 用10mL 0.05mol•L-1的NaOH溶液可恰好中和混合体系中的HA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
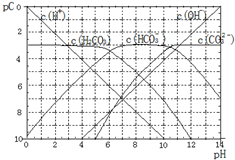
| A. | 某温度下,CO2饱和溶液的浓度是0.05mol•L-1,其中$\frac{1}{5}$的CO2转变为H2CO3,若此时溶液的pH约为5,据此可得该温度下CO2饱和溶液中H2CO3的电离度为0.1% | |
| B. | 25℃时,H2CO3一级电离平衡常数的数值Ka1=10-6 | |
| C. | 向Na2CO3溶液中滴加盐酸至pH等于11时,溶液中:c(Na+)+c(H+)=2c(CO${\;}_{3}^{2-}$)+c(OH-)+c(HCO${\;}_{3}^{-}$) | |
| D. | 25℃时,0.1mol/LNa2CO3中C(HCO${\;}_{3}^{-}$)比0.1mol/LH2CO3中C(HCO${\;}_{3}^{-}$)大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com