
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
 .
.分析 (1)由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为F、⑥为Na、⑦为Al、⑧为S,⑨为Cl;
(2)⑨为Cl元素,原子核内有17个质子,核外有3个电子层,各层电子数为2、8、7;
(3)③为N、④为O、⑧为S,同周期从左到右非金属性增强,同主族元素从上到下非金属性减弱;
(4)同周期自左而右,元素金属性减弱;
(5)⑧为S元素,硫的最高价氧化物为三氧化硫,化学式为:SO3.
解答 解:(1)由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为F、⑥为Na、⑦为Al、⑧为S,⑨为Cl,⑦为Al元素,元素名称为铝,
故答案为:铝;
(2)在原子结构示意图中,圆圈表示原子核,圆圈内的数值为质子数,核外电子层用弧线表示,弧线上的数据表示每层的电子数,氯原子示意图为: ;
;
故答案为: ;
;
(3)同周期从左到右非金属性增强,则O<F,同主族元素从上到下非金属性减弱:O>S,所以非金属性由强到弱的顺序是:F>O>S,
故答案为:F>O>S;
(4)同周期自左而右,元素金属性减弱,故金属性Na>Al,
故答案为:>;
(5)⑧为S元素,硫为16号元素,原子最外层电子数为6,最高价为+6价,其氧化物为三氧化硫,化学式为:SO3,
故答案为:SO3.
点评 本题考查元素的推断,根据元素在周期表中的物质可推断出元素的种类,题中侧重于周期律的应用,学习中注意积累相关知识,题目难度中等.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{ac}{22400}$mol•L-1 | B. | $\frac{a}{22.4b}$mol•L-1 | ||
| C. | $\frac{ac}{22400b+36.5}$mol•L-1 | D. | $\frac{1000ac}{22.4b+36.5a}$mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 s | B. | 12 s | C. | 大于12 s | D. | 小于12 s |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加甲基橙呈黄色的溶液 | B. | pH=7 的溶液 | ||
| C. | c(H+)=10-14mol/L的溶液 | D. | c(OH-)=$\sqrt{Kw}$ 的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
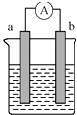 如图是某化学兴趣小组探究不同条件下化学能转化为电能的装置.请回答下列问题.
如图是某化学兴趣小组探究不同条件下化学能转化为电能的装置.请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②④⑥ | C. | ①③⑤ | D. | ③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 任何放热反应在常温条件下一定能够发生 | |
| C. | 总能量大于生成物总能量的反应是吸热反应 | |
| D. | 反应物和生成物所具有的总能量的差决定了化学反应是放热还是吸热反应物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com