
【题目】下列解释实验事实的化学方程式或离子方程式不正确的是
A.氯气用于自来水的杀菌消毒:Cl2+H2O![]() HCl+HClO
HCl+HClO
B.将“NO2球”浸泡在热水中,颜色变深:2NO2(g)![]() N2O4(g)
N2O4(g)![]() H<0
H<0
C.向Ba(OH)2溶液中滴加NaHSO4溶液,至溶液呈中性:OH-+ Ba2++ H++SO42-= BaSO4↓+ H2O
D.铜片溶解在KNO3和稀硫酸的混合液中:3Cu + 8H+ + 2NO3- =3Cu2+ + 2NO↑ + 4H2O
科目:高中化学 来源: 题型:
【题目】我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。
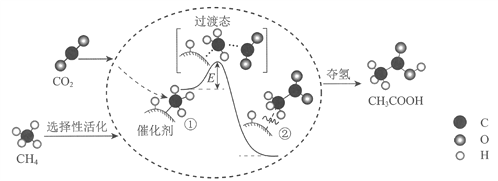
下列说法不正确的是
A. 生成CH3COOH总反应的原子利用率为100%
B. CH4→CH3COOH过程中,有C―H键发生断裂
C. ①→②放出能量并形成了C―C键
D. 该催化剂可有效提高反应物的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属锰及化合物广泛应用于工业生产、制造业等领域。
(1)科研人员将锰粉碎后加入到![]() 溶液中使其浸出(假定杂质不反应,溶液体积不变),发生反应
溶液中使其浸出(假定杂质不反应,溶液体积不变),发生反应![]() (已知含
(已知含![]() 水溶液为米黄色)
水溶液为米黄色)
①为加快上述反应速率可以采取的措施有________________(写出一条即可)。
②下列说明反应已达平衡的有_______(填编号)。
A.溶液的颜色不发生变化
B.溶液中![]()
C.体系中固体的质量不变
D.![]() 与
与![]() 浓度的比值保持不变
浓度的比值保持不变
③室温下,测得溶液中阳离子浓度![]() 随时间的变化情况如下图所示,则上述反应的平衡常数K=________________,
随时间的变化情况如下图所示,则上述反应的平衡常数K=________________,![]() 的转化率为______________。
的转化率为______________。
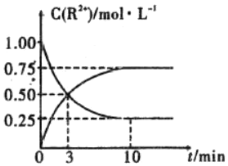
④若其他条件不变,10mim后向容器中迅速加入蒸馏水至溶液体积变为原来的2倍,则再次平衡时![]() =_____________(不考虑离子水解的影响)。
=_____________(不考虑离子水解的影响)。
(2)电解制锰后的废水中含有Mn2+,常用石灰乳进行一级沉降得到Mn(OH)2沉淀,过滤后再向滤液中加入等体积的Na2S溶液,进行二级沉降,为了将Mn2+的浓度降到![]() ,则加入的Na2S溶液的浓度至少是______________mol/L[已知
,则加入的Na2S溶液的浓度至少是______________mol/L[已知![]() ]
]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用![]() 与浓盐酸反应制备
与浓盐酸反应制备![]() 。
。
(1)制备反应会因盐酸浓度下降面停止。为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:
甲方案:与足量![]() 溶液反应,称量生成的
溶液反应,称量生成的![]() 质量。
质量。
乙方案:采用酸碱中和滴定法测定。
丙方案:与己知量![]() (过量)反应,称量剩余的
(过量)反应,称量剩余的![]() 质量。
质量。
丁方案:与足量![]() 反应,测量生成的
反应,测量生成的![]() 体积。
体积。
继而进行下列判断和实验:
①判定甲方案不可行。现由是_________。
②进行乙方案实验;准确量取残余清液稀释一定倍数后作为试样。
a.量取试样![]() ,用
,用![]() 标准溶液滴定,选择的指示剂是____,消耗
标准溶液滴定,选择的指示剂是____,消耗![]() ,该次滴定测得试样中盐酸浓度为_______
,该次滴定测得试样中盐酸浓度为_______![]()
b._________,获得实验结果。
③判断两方案的实验结果________(填“偏大”、“偏小”或“准确”).
[已知:![]() 、
、![]() ]
]
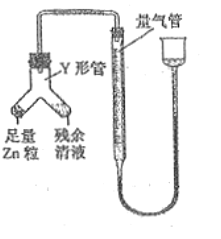
④进行丁方案实验:装置如图所示(夹持器具已略去)。
a.使Y形管中的残余清液与锌粒反应的正确操作是将_______转移到____中。
b.反应完毕,每间隔1分钟读取气体体积,气体体积逐次减小,直至不变。气体体积逐次减小的原因是__________(排除仪器和实验操作的影响因素),至体积不变时,量气管的左侧液面高于右侧液面,此时读数测得的体积__________(填“偏大”、“偏小”或“准确”)
(2)若没有酒精灯,也可以采用![]() 与浓盐酸反应制取适量氯气的如下简易装置。
与浓盐酸反应制取适量氯气的如下简易装置。
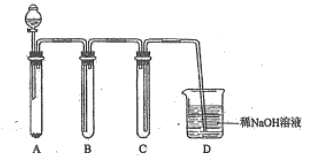
装置B、C、D的作用分别是:
B___________C______________D______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一条河边有四座工厂:甲、乙、丙、丁(如图所示),它们所排出的废液里每厂只含有NaHCO3、FeCl3、Ca(OH)2、HCl中的一种。某环保小组对河水监测时发现:

①甲处河水呈乳白色
②乙处河水有红褐色沉淀
③丙处河水由浑浊变澄清
④丁处河水产生气泡,河水仍澄清
请推断四座工厂排出的废液里含有的物质分别是(填化学式):
甲:___,乙:___,丙:___,丁:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关硅及其化合物的说法不正确的是( )
A.晶体硅具有金属光泽,可以导电,属于金属材料
B.常温下,硅化学性质稳定,自然界中的硅主要以氧化物及硅酸盐的形式存在
C.![]() 是一种酸性氧化物,能够与强碱反应生成相应的盐
是一种酸性氧化物,能够与强碱反应生成相应的盐
D.除去![]() 中混有的
中混有的![]() 可加入适量的稀盐酸,然后再过滤
可加入适量的稀盐酸,然后再过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年1月3日上午,嫦娥四号探测器翩然落月,首次实现人类飞行器在月球背面的软着陆。所搭载的“玉兔二号”月球车,通过砷化镓(GaAs)太阳能电池提供能量进行工作。回答下列问题:
(1)基态As原子的价电子排布图为____________,基态Ga原子核外有________个未成对电子。
(2)镓失去电子的逐级电离能(单位:kJmol-1)的数值依次为577、1985、2962、6192,由此可推知镓的主要化合价为____和+3,砷的电负性比镓____(填“大”或“小”)。
(3)1918年美国人通过反应:HC≡CH+AsCl3![]() CHCl=CHAsCl2制造出路易斯毒气。在HC≡CH分子中σ键与π键数目之比为________;AsCl3分子的空间构型为___________。
CHCl=CHAsCl2制造出路易斯毒气。在HC≡CH分子中σ键与π键数目之比为________;AsCl3分子的空间构型为___________。
(4)砷化镓可由(CH3)3Ga和AsH3在700℃制得,(CH3)3Ga中碳原子的杂化方式为_______
(5)GaAs为原子晶体,密度为ρgcm-3,其晶胞结构如图所示, Ga与As以_______键键合。Ga和As的原子半径分别为a pm和b pm,设阿伏伽德罗常数的值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为_______________(列出计算式,可不化简)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用氨气和氢气直接合成氨,并通过下列转化过程制备硝酸:
![]()
(1)上述物质中为红棕色气体的是____(填化学式);
(2)NH3溶于水所得溶液呈___(填“酸性”、 “碱性”或“中性” );
(3)配平NO2→HNO3的化学方程式:3NO2 +H2O = ___HNO3 + NO。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mL0.1mol/L的某一元酸HR溶液中逐滴加入0.1mol/L氨水,所得溶液pH及导电能力变化如图。下列分析不正确的是( )
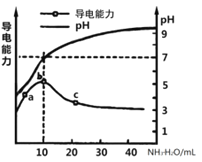
A. a~b点导电能力增强说明HR为弱酸
B. a、b点所示溶液中水的电离程度不相同
C. b恰好完全中和,pH=7说明NH4R没有水解
D. c 点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com