
| 元素编号 | 元素性质或原子结构 |
| A | 有三个电子层,K、M层电子数之和等于L层电子数 |
| B | 短周期中金属性最强 |
| C | 常温下单质为双原子分子,氢化物的水溶液呈碱性 |
| D | 元素高正价是+7价 |
 .
.分析 A元素原子有三个电子层,K、M层电子数之和等于L层电子数,则其M层电子数=8-2=6,故A为硫;B在短周期中金属性最强,则B为Na;常温下C单质为双原子分子,氢化物的水溶液呈碱性,则C为氮元素;D元素最高正价是+7价,且为短周期元素,故D为Cl,
(1)①主族元素周期数=电子层数、族序数=最外层电子数;
②Na2S属于离子化合物,钠原子与硫原子的电子式表示硫化钠的形成;
(2)元素氢化物稳定性,元素最高价含氧酸的酸性强弱,单质之间的相互置换等可以判断元素非金属性强弱;
(3)A、B、C、D四种元素的最高价氧化物的水化物分别为:硫酸、氢氧化钠、硝酸、高氯酸,氢氧化钠属于碱;
(4)X是由S、Na、N、Cl四种元素中的某种元素组成的单质,
①若Y是有刺激性气味的无色气体,硫元素单质化合物性质符合,可推知X为硫、Y为SO2、Z为SO3、W为H2SO4,SO2被氧化为硫酸,硫酸与氯化钡反应生成硫酸钡与盐酸;
②若Z是红棕色气体,则Z为NO2,则X为N2、Y为NO、W为HNO3,则Z→W的反应为3NO2+H2O=2HNO3+NO,结合氮元素化合价变化判断.
解答 解:A元素原子有三个电子层,K、M层电子数之和等于L层电子数,则其M层电子数=8-2=6,故A为硫;B在短周期中金属性最强,则B为Na;常温下C单质为双原子分子,氢化物的水溶液呈碱性,则C为氮元素;D元素最高正价是+7价,且为短周期元素,故D为Cl,
(1)①A为S元素,原子核外有3个电子层、最外层电子数为6,处于周期表中第三周期第ⅥA族,
故答案为:第三周期第ⅥA族;
②Na2S属于离子化合物,钠原子与硫原子的电子式表示硫化钠的形成为: ,
,
故答案为: ;
;
(2)元素氢化物稳定性,元素最高价含氧酸的酸性强弱,单质之间的相互置换等可以判断元素非金属性强弱,物质的状态属于物理性质,不能比较非金属性强弱,与钠的反应不能比较非金属性强弱,
故答案为:bde;
(3)A、B、C、D四种元素的最高价氧化物的水化物分别为:硫酸、氢氧化钠、硝酸、高氯酸,氢氧化钠属于碱,其它三种化合物属于酸,
故答案为:NaOH;
(4)X是由S、Na、N、Cl四种元素中的某种元素组成的单质,
①若Y是有刺激性气味的无色气体,硫元素单质化合物性质符合,可推知X为硫、Y为SO2、Z为SO3、W为H2SO4,SO2通入BaCl2溶液中,然后滴加适量H2O2溶液,SO2被氧化性为硫酸,硫酸与氯化钡反应生成硫酸钡与盐酸,白色沉淀为BaSO4,该反应的化学方程式为:BaCl2+SO2+H2O2=BaSO4↓+2HCl,
故答案为:BaSO4;BaCl2+SO2+H2O2=BaSO4↓+2HCl;
②若Z是红棕色气体,则Z为NO2,则X为N2、Y为NO、W为HNO3,则Z→W的反应为3NO2+H2O=2HNO3+NO,反应中二氧化氮是氧化剂、还原剂,其氧化剂的二氧化氮生成NO,其还原剂的二氧化氮生成硝酸,故氧化剂与还原剂物质的量之比=1:2,
故答案为:1:2.
点评 本题考查结构性质位置关系应用、无机物推断等,明确元素种类是解答的关键,注意掌握非金属性、金属键强弱比较规律,难度中等.


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:选择题
 ═2CuI↓+13I2+□K2SO4+□
═2CuI↓+13I2+□K2SO4+□ ,生成的I2刚好消耗n mol S2O32-(S2O32-被氧化为S4O62-),则参加反应的Cu(IO3)2物质的量为( )
,生成的I2刚好消耗n mol S2O32-(S2O32-被氧化为S4O62-),则参加反应的Cu(IO3)2物质的量为( )| A. | $\frac{n}{10}$ mol | B. | $\frac{n}{11}$ mol | C. | $\frac{n}{12}$ mol | D. | $\frac{n}{13}$ mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合物:干冰,冰水混合物,烧碱,小苏打 | |
| B. | 非电解质:乙醇,四氯化碳,氯气,葡萄糖 | |
| C. | 同素异形体:活性炭,C60,C80,金刚石 | |
| D. | 混合物:漂白粉,纯净矿泉水,分析纯盐酸,石灰石 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 E的氢化物的电子式
E的氢化物的电子式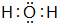 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜和稀硝酸反应 | B. | 氮气和氧气发生反应 | ||
| C. | 二氧化氮气体溶于水 | D. | 氨的催化氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.27 s | B. | 0.44 s | C. | 1.33 s | D. | 2 s |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①<②<③<④<⑤ | B. | ④<②<①<③<⑤ | C. | ②<④<③<①<⑤ | D. | ②<④<①<③<⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com