
【题目】NH4X(X为卤素原子)的能量关系如下图所示。下列说法正确的是
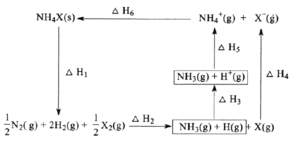
A. H1<H5
B. H6=H1+H2+H3+H4+H5
C. 已知NH4Cl溶于水吸热,则H6>0
D. 相同条件下,NH4Cl的(H2+H3+H5)比NH4Br的大
 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
【题目】今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是

A. 原子半径:W<X
B. 常温常压下,Y单质为固态
C. 气态氢化物热稳定性:Z<W
D. X的最高价氧化物的水化物是强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由Al、CuO、Fe2O3组成的混合物共10.0g,放入500mL某浓度的盐酸中,混合物完全溶解,当再加入250mL 2.00mol/L的NaOH溶液时,得到沉淀最多。上述盐酸的浓度为( )
A. 1.00 mol/LB. 0.500 mol/L
C. 2.00 mol/LD. 3.00 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学教师为 “氯气与金属钠反应”设计了如图装置的实验。实验操作:先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟。以下叙述中错误的是( )

A. 反应生成的大量白烟是氯化钠晶体
B. 玻璃管尾部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气,以免其污染空气
C. 钠着火燃烧产生苍白色火焰
D. 发生的反应为2Na+Cl2![]() 2NaCl
2NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:① CH3CH=CHCH2CH3![]() CH3COOH+CH3CH2COOH
CH3COOH+CH3CH2COOH
② R-CH=CH2![]() R-CH2-CH2-Br
R-CH2-CH2-Br
香豆素的核心结构是芳香内酯A,A经下列步骤转变为水杨酸。
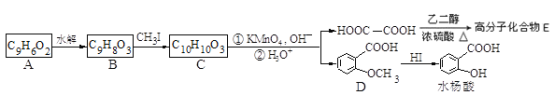
请回答下列问题:
(1)下列有关A、B、C的叙述中不正确的是___________
a. C中核磁共振氢谱共有8种峰
b. A、B、C均可发生加聚反应
c. 1mol A最多能和5mol氢气发生加成反应
d. B能与浓溴水发生取代反应
(2)B分子中有2个含氧官能团,分别为______和______(填官能团名称),B→C的反应类型为_____________。
(3)在上述转化过程中,反应步骤B→C的目的是_________________________。
(4)化合物D有多种同分异构体,其中一类同分异构体是苯的对二取代物,且水解后生成的产物之一能发生银镜反应。请写出其中一种的结构简式:_____________。
(5)写出合成高分子化合物E的化学反应方程式:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气中CO2含量的增多除了导致地球表面温度升高外,还会影响海洋生态环境。某研究小组在实验室测得不同温度下(T1,T2)海水中CO32-浓度与模拟空气中CO2浓度的关系曲线。下列说法不正确的是
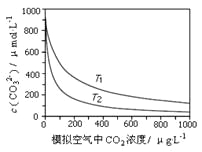
A. T1>T2
B. 海水温度一定时,大气中CO2浓度增加,海水中溶解的CO2随之增大,导致CO32-浓度降低
C. 当大气中CO2浓度确定时,海水温度越高,CO32- 浓度越低
D. 大气中CO2含量增加时,海水中的珊瑚礁将逐渐溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用少量的溴和足量的乙醇制备1,2—二溴乙烷,反应原理为:CH3CH2OH![]() CH2=CH2↑+H2O;CH2=CH2+Br2→BrCH2CH2Br。制备装置如图所示:
CH2=CH2↑+H2O;CH2=CH2+Br2→BrCH2CH2Br。制备装置如图所示:

下列说法中不正确的是( )
A. 使用恒压低液漏斗的目的是防止有机物挥发,使漏斗内液体顺利滴下
B. 实验中为了防止有机物大量挥发,应缓慢升高反应温度至170℃
C. 装置C中应加入氢氧化钠溶液,以吸收反应中可能生成的酸性气体
D. 实验过程中应用冷水冷却装置D,以避免溴的大量挥发
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含 70%Cu、25%Al、4%Fe 及少量 Au、Pt 的合金,并设计出由合金制备硫酸铜和硫酸铝晶体的路线:

请回答下列问题:
(1)第①步 Cu与酸反应的离子方程式为__________________,得到滤渣 1的主要成分为_______________。
(2)第②步加 H2O2的作用是做氧化剂,将溶液中的 Fe2+氧化为 Fe3+,用 H2O2做氧化剂的优点是____________________。
(3)滤渣 2的主要成分是 Al(OH)3和 Fe(OH)3,在生产中如何分离两种沉淀,写出反应的离子方程式______________。
(4)第③步蒸发所需玻璃仪器为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型的乙醇电池,它用磺酸类质子溶剂。电池总反应为:C2H5OH +3O2→ 2CO2+3H2O,电池示意如图,下列说法正确的是

A. a极为电池的正极
B. 电池工作时电流由a极沿导线经灯泡再到b极
C. 电池负极的电极反应为:4H++ O2+ 4e-= 2H2O
D. 电池工作时,1mol乙醇被氧化时就有12mol电子转移
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com