
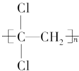
 )具有超强阻隔性能,可作为保鲜食品的包装材料.它是由CCl2=CH2(写结构简式)发生加聚反应生成的.
)具有超强阻隔性能,可作为保鲜食品的包装材料.它是由CCl2=CH2(写结构简式)发生加聚反应生成的.分析 (1)聚偏二氯乙烯( )的单体是CCl2=CH2;
)的单体是CCl2=CH2;
(2)亚油酸中含有碳碳双键和羧基,具有烯烃和羧酸的性质,能发生氧化反应、还原反应、加聚反应、加成反应、取代反应、酯化反应、中和反应;
(3)甲醇和钠反应生成甲醇钠和氢气;
(4)碘遇淀粉试液变蓝色,所以可以用碘检验淀粉.
解答 解:(1)聚偏二氯乙烯( )的单体是CCl2=CH2,故答案为:CCl2=CH2;
)的单体是CCl2=CH2,故答案为:CCl2=CH2;
(2)A.根据结构简式知,亚油酸的分子式为C18H32O2,故A错误;
B.含有羧基,一定条件下能与乙醇发生酯化反应,故B错误
C.含有羧基,所以能和NaOH溶液发生中和反应,故C正确;
D.含有碳碳双键,所以能被酸性高锰酸钾溶液氧化而使酸性KMnO4溶液褪色,故D正确;
故选CD;
(3)甲醇和钠反应生成甲醇钠和氢气,反应方程式为:2Na+2CH3OH→2CH3ONa+H2↑,故答案为:2Na+2CH3OH→2CH3ONa+H2↑;
(4)碘遇淀粉试液变蓝色,所以可以用碘检验淀粉,其检验方法是取少量水解后的溶液于试管中,加入碘水,如果溶液不变蓝,则淀粉水解完全,反之,水解不完全,
故答案为:取少量水解后的溶液于试管中,加入碘水,如果溶液不变蓝,则淀粉水解完全,反之,水解不完全.
点评 本题考查高聚物中单体判断、物质检验、方程式的书写等知识点,明确官能团及其性质关系是解本题关键,难点是物质检验方案设计,注意化学用语的正确运用,题目难度中等.


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 反应现象相同,反应类型相同 | B. | 反应现象相同,反应类型不同 | ||
| C. | 反应现象不同,反应类型相同 | D. | 反应现象不同,反应类型不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| CuCl产率 | 70 | 90 | 82 | 78 | 75 | 72 | 70 |
| 平行实验次数 | 1 | 2 | 3 |
| 0.25g样品消耗硫酸铈标准溶液的体积(mL) | 24.35 | 24.05 | 23.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 为了研究化学反应A+B=C+D的能量变化情况,某同学设计了如图所示装置.当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升.试回答下列问题:
为了研究化学反应A+B=C+D的能量变化情况,某同学设计了如图所示装置.当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 分析图,回答以下问题:
分析图,回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 第ⅤA族元素的原子R与A原子结合形成RA3气态分子,其立体结构呈三角锥形.RCl5在气态和液态时,分子结构如图所示,下列关于RCl5分子的说法中不正确的是( )
第ⅤA族元素的原子R与A原子结合形成RA3气态分子,其立体结构呈三角锥形.RCl5在气态和液态时,分子结构如图所示,下列关于RCl5分子的说法中不正确的是( )| A. | 分子中5个R-Cl键键能不都相同 | |
| B. | 键角(Cl-R-Cl)有90°、120、180°几种 | |
| C. | RCl5受热后会分解生成分子立体结构呈三角锥形的RCl3 | |
| D. | 每个原子都达到8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 以氮化镓(GaN)为代表的第三代半导体材料目前已成为全球半导体研究的前沿和热点.回答下列问题:
以氮化镓(GaN)为代表的第三代半导体材料目前已成为全球半导体研究的前沿和热点.回答下列问题: .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com