
| A. | SO2、SO3都是极性分子 | |
| B. | 在H3O+和[Cu(H2O)4]2+中都存在配位键 | |
| C. | 元素电负性越大的原子,该元素的原子吸引键合电子的能力越强 | |
| D. | 原子晶体中原子以共价键结合,具有键能大、熔点高、硬度大的特性 |
分析 A.对于ABn型分子,若中心原子的化合价的绝对值等于原子的最外层电子数,则为非极性分子,反之不是;
B.含有孤电子对和含有空轨道的原子之间能形成配位键;
C.非金属性越强,电负性越大,该元素的原子吸引电子的能力越强;
D.根据原子晶体物理性质分析.
解答 解:A.SO2分子中S的最外层有6个电子,其化合价为+4,中心原子的化合价的绝对值不等于原子的最外层电子数,属于极性分子,SO3分子中S的最外层有6个电子,其化合价为+6,中心原子的化合价的绝对值等于原子的最外层电子数,属于非极性分子,故A错误;
B.水分子中的O原子含有孤电子对,H+有空轨道,所以H3O+存在配位键,Cu2+有空轨道,H2O中的氧原子上的孤电子对,可以形成配位键,故B正确;
C.非金属性越强,电负性越大,该元素的原子吸引电子的能力越强,故C正确;
D.原子晶键能大、熔点高、硬度大是因为原子之间以共价键结合,共价键键能大,熔化时要破坏共价键,故D正确;
故选A.
点评 本题考查了分子极性的判断,配位键,电负性,原子晶体的性质,题目考查知识点较多,但是较基础,注意ABn型分子极性的判断技巧,题目难度不大.


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 物质的摩尔质量就是1mol物质的质量 | |
| B. | 1mol水的质量、水的摩尔质量和水的相对分子质量在数值上都是18 | |
| C. | 各种物质的摩尔质量不可能相同 | |
| D. | 与物质的质量、物质的量多少无关,但与相对分子质量一样都是物质的基本属性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
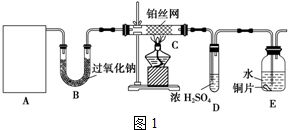
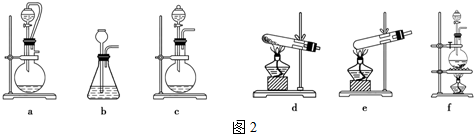
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C4H9OH | B. | CH2=CHCOOH | C. | CH2=CHCHO | D. | CH3CH2COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液:K-、Na+、Cu2+、OH- | |
| B. | 由水电离出的c(OH-)=10-13mol/L的溶液中:Na+、Ba2+、Cl-、Br+- | |
| C. | 加入Al能放出H2的溶液中:Cl-、HCO3-、SO42-、NH4+ | |
| D. | 有较多Fe3+的溶液中:Na+、NH4+、SCN-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | c (Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | B. | c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-) | ||
| C. | c (Na+)>c(HA-)>c(OH-)>c(A2-)>c(H+) | D. | c(Na+)=c(HA-)+c(HA)+2c(A2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com