
| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 64.7 | 249 | 199.6 |
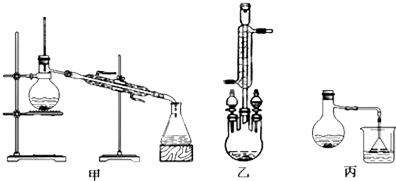
分析 (1)给液体加热加入碎瓷片可以防止瀑沸;如果加热一段时间后发现忘记加瓷片,应等冷却后补加;
(2)根据 酯化反应中浓硫酸的作用进行解答,浓硫酸的密度较大,且与苯甲酸、甲醇混合放出大量热量,甲醇易挥发,从实验安全和反应的物质的转化率角度分析;
(3)根据甲图、乙图装置的圆底烧瓶上没有冷凝管及甲醇易挥发进行分析;
(4)蒸馏用于互溶但沸点相差较大的两种(或两种以上)液体分离;
(5)氢氧化钠是强碱,促进苯甲酸甲酯的水解,据此答题;
(6)产率=$\frac{实际产量}{理论产量}$×100%,根据反应物的物质的量判断过量,根据不足量计算出理论上生成苯甲酸甲酯的物质的量,再计算出其产率.
解答 解:(1)给液体加热加入碎瓷片可以防止瀑沸;如果加热一段时间后发现忘记加瓷片,应等冷却后补加,选B,
故答案为:防止瀑沸;B;
(2)浓硫酸在酯化反应中起到了催化剂作用,酯化反应为可逆反应,浓硫酸吸收反应生成的水,可以促进酯的生成,浓硫酸起到了吸水剂的作用,浓硫酸的密度较大,且与苯甲酸、甲醇混合放出大量热量,甲醇易挥发,从实验安全和反应的物质的转化率角度看混合液体时最后加入浓硫酸,
故答案为:催化剂、吸水剂;浓硫酸密度较大,且与苯甲酸、甲醇混合放出大量热量,甲醇易挥发;
(3)由装置图可知,乙图的圆底烧瓶上有冷凝管,充分起到回流作用,甲图和丙图则没有,而本题中反应物甲醇沸点低,苯甲酸、苯甲酸甲酯的沸点远高于甲醇,若采用甲图、丙图,甲醇必定会大量挥发,不利于合成反应,所以应冷凝回流,减少甲醇的挥发,提高产率,
故答案为:乙;
(4)甲醇和苯甲酸甲酯相互溶解,二者沸点不同,可以通过蒸馏操作分离,
故答案为:蒸馏;
(5)氢氧化钠是强碱,促进苯甲酸甲酯的水解,所以不能用NaOH溶液代替饱和碳酸钠溶液,
故答案为:氢氧化钠是强碱,促进苯甲酸甲酯的水解,导致产品损失;
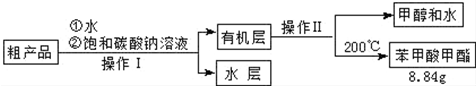
(6)9.6ml(密度约为1.27g.ml-1)苯甲酸的质量为12.2g,其物质的量为:$\frac{12.2g}{122g/mol}$=0.1mol,20mL甲醇(密度约0.79g/mL)的物质的量为:$\frac{0.79g/mL×20mL}{32g/mol}$=0.49mol>0.1mol,
则理论上生成苯甲酸甲酯的物质的量为:0.1mol,质量为:136g/mol×0.1mol=13.6g,则苯甲酸甲酯的产率为:$\frac{8.84g}{13.6g}$×100%=65%,
故答案为:65%.
点评 本题通过苯甲酸甲酯的制备方法,考查了物质制备方案的设计与评价,题目难度中等,明确物质的制备原理为解答此类题的关键,该烃为乙酸乙酯的制备知识的迁移题目,充分考查了学生灵活应用所学知识的能力.


 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4、9、24、14、28 | B. | 1、1、1、1、2 | C. | 8、9、12、10、20 | D. | 任意比均可 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
 +Br2$\stackrel{Fe}{→}$
+Br2$\stackrel{Fe}{→}$ +HBr.
+HBr.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
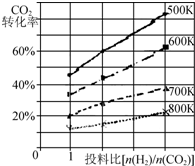 将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(g);△H
将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(g);△H查看答案和解析>>
科目:高中化学 来源: 题型:解答题
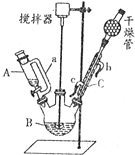 丙烯酸乙酯(CH2═CHCOOCH2CH3,密度为0.94g/mL)可广泛用于涂料、粘合剂的制造、皮革加工等方面.某实验小组利用如图所示的装置合成丙烯酸乙酯(部分夹持及加热装置已省略).
丙烯酸乙酯(CH2═CHCOOCH2CH3,密度为0.94g/mL)可广泛用于涂料、粘合剂的制造、皮革加工等方面.某实验小组利用如图所示的装置合成丙烯酸乙酯(部分夹持及加热装置已省略).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液颜色保持不变,说明上述可逆反应达到平衡状态 | |
| B. | 若用绿矾(FeSO4•7H2O)(M=278)作还原剂,处理1L废水,至少需要917.4 g | |
| C. | 常温下转化反应的平衡常数K=l04,则转化后所得溶液的pH=1 | |
| D. | 常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中的c(Cr3+ )降至1×10-5mol/L,应调溶液的pH=5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只要选择适宜的条件,SO2和O2就能全部转化为SO3 | |
| B. | 该反应达到平衡后,反应就停止了,即正逆反应速率为零 | |
| C. | 在达到平衡的体系中,充入O2,对化学平衡无影响 | |
| D. | 在工业合成SO3时,要同时考虑反应速率和反应所能达到的限度两个方面的问题 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第三周期元素的最高正化合价等于它所处的族序数 | |
| B. | 主族族序数与价电子数相同 | |
| C. | 非金属元素在化合物中既可显正价又可显负价 | |
| D. | 所有非金属元素的负化合价等于使原子达到8电子稳定结构所需得到的电子数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com