
 是由
是由 经两种反应而制得的,这两种反应依次是( )
经两种反应而制得的,这两种反应依次是( )| A. | 消去、加聚 | B. | 水解、缩聚 | C. | 氧化、缩聚 | D. | 取代、加聚 |
科目:高中化学 来源: 题型:解答题

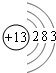 ,它的单质能(填能或不能)与氢氧化钠溶液反应.
,它的单质能(填能或不能)与氢氧化钠溶液反应.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 同族元素,随着电子层的增加,I1逐渐增大 | |
| B. | 通常情况下,电离能I1<I2<I3 | |
| C. | 同周期元素,随着核电荷数的增加,I1呈增大趋势 | |
| D. | 电离能越小,元素的金属性越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 白磷与氧气可发生如下反应:P4+5O2═P4O10.已知断裂下列1mol化学键需要吸收的能量分别为:P-P a kJ、P-O b kJ、P=O c kJ、O=O d kJ.根据下图所示的分子结构和有关数据估算1mol P4发生该反应放出的热量是( )
白磷与氧气可发生如下反应:P4+5O2═P4O10.已知断裂下列1mol化学键需要吸收的能量分别为:P-P a kJ、P-O b kJ、P=O c kJ、O=O d kJ.根据下图所示的分子结构和有关数据估算1mol P4发生该反应放出的热量是( )| A. | (6a+5d-4c-12b) kJ | B. | (4c+12b-6a-5d) kJ | C. | (4c+12b-4a-5d) kJ | D. | (5a+5d-4c-12b) kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
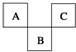 如图是周期表中短周期的一部分,A、B、C三种元素原子核外电子数之和等于B的质量数.B原子核内质子数和中子数相等.下面叙述中不正确的是( )
如图是周期表中短周期的一部分,A、B、C三种元素原子核外电子数之和等于B的质量数.B原子核内质子数和中子数相等.下面叙述中不正确的是( )| A. | 三种元素的原子半径的大小顺序是B<A<C | |
| B. | A元素最高价氧化物对应水化物具有强氧化性和不稳定性 | |
| C. | B元素的氧化物和氢化物的水溶液都呈酸性 | |
| D. | C元素的单质是非金属单质中唯一能跟水激烈反应的单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
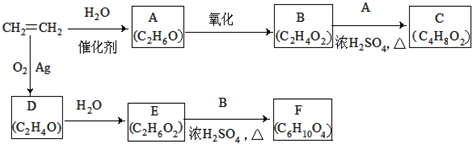
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
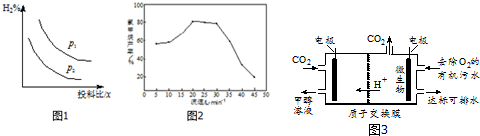
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com