
【题目】一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s) + CO2(g)![]() 2CO(g),平衡时,体系中气体体积分数与温度的关系如下图所示:
2CO(g),平衡时,体系中气体体积分数与温度的关系如下图所示:
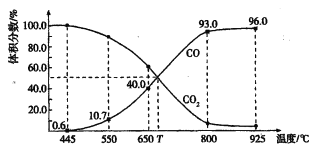
已知:气体分压(P分)=气体总压(p总)×体积分数。下列说法正确的是
A. 550℃时,若充入惰性气体,V正、V逆均减小,平衡不移动
B. 650℃时,反应达平衡后CO2的转化率为40.0%
C. T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D. 925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp= 23. 04p总
【答案】D
【解析】A,550℃,若充入惰性气体,容器的压强不变,容器的体积增大,相当于减小压强,υ正、υ逆均减小,平衡向正反应方向移动,A项错误;B,由图知650℃时,CO的体积分数为40%,CO2的体积分数为60%,平衡时n(CO2):n(CO)=60%:40%=3:2,设CO2平衡物质的量为3mol,CO平衡物质的量为2mol,生成2molCO消耗1molCO2,反应达到平衡时CO2的转化率为![]() 100%=25%,B项错误;C,T℃平衡时CO与CO2的体积分数相等,若充入等体积的CO2和CO即为平衡状态,平衡不移动,C项错误;D,925℃时CO的体积分数为96%,CO2的体积分数为4%,CO的分压为0.96p总,CO2的分压为0.04p总,用平衡分压代替平衡浓度表示的化学平衡常数Kp=(0.96p总)2
100%=25%,B项错误;C,T℃平衡时CO与CO2的体积分数相等,若充入等体积的CO2和CO即为平衡状态,平衡不移动,C项错误;D,925℃时CO的体积分数为96%,CO2的体积分数为4%,CO的分压为0.96p总,CO2的分压为0.04p总,用平衡分压代替平衡浓度表示的化学平衡常数Kp=(0.96p总)2![]() (0.04p总)=23.04p总;答案选D。
(0.04p总)=23.04p总;答案选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】实验室常用的几种气体发生装置如图A、B、C所示:

(1)实验室可以用B或C装置制取氧气:
Ⅰ、如果用B装置,通常使用的药品是______;
Ⅱ、如果用C装置,通常使用的药品是______;
Ⅲ、检查B装置气密性的操作方法是______。
(2)气体的性质是气体收集方法选择的主要依据。下列性质与收集方法无关的是____(填序号,下同)。
①密度 ②颜色 ③溶解性 ④热稳定性 ⑤与氧气反应
(3)若用A装置与D装置相连制取并收集X气体,则X可能是下列气体中的____。
① CO2 ② H2 ③ Cl2
Ⅰ、写出A装置中反应的离子方程式并用单线桥标出电子转移方向和数目:____。
Ⅱ、D装置中小烧杯中应盛放____,目的是____。
Ⅲ、若要收集干燥纯净的X气体,上述装置应如何改进:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mL0.1mol·![]() 的HA溶液中逐滴滴入0.1mol·
的HA溶液中逐滴滴入0.1mol·![]() 的ROH溶液,所得溶液pH及导电能力的变化如图,下列判断正确的是
的ROH溶液,所得溶液pH及导电能力的变化如图,下列判断正确的是
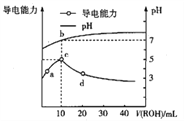
A. ROH在溶液中的电离方程式为![]()
B. c点由![]() 电离出的
电离出的![]() 浓度最小
浓度最小
C. b点存在: ![]()
D. 若升高温度,a、d两点pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向体积均为10 mL、物质的量浓度相同的两份NaOH 溶液中分别通入一定量的CO2,得到溶液甲和乙。向甲、乙两溶液中分别滴加0.1mol/L的盐酸,此时反应生成CO2体积(标准状况)与所加盐酸体积的关系如图所示。则下列叙述中不正确的是

A. 原NaOH溶液的物质的量浓度为0.5 mol/L
B. 当0盐酸)<10 mL时,甲溶液中发生反应的离子方程式为H++CO32-=HCO3-
C. 乙溶液中含有的溶质是Na2CO3、NaOH
D. 向乙溶液中滴加过量盐酸后产生CO2体积的最大值为224 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.2L由NaCl、MgCl2、CaCl2组成的混合溶液中,部分离子浓度大小如图所示,回答下列问题:

(1)该混合液中,NaCl的物质的量为_____mol,含溶质MgCl2的质量为_____g。
(2)该混合液中CaCl2的物质的量为_______mol,将该混合液加水稀释至体积为1L,稀释后溶液中Ca2+的物质的量浓度为______mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,pH=l 的某溶液 A 中除H+外,还含有NH4+、K+、Na+、Fe3+、Al3+、Fe2+、CO32-、NO3-、 Cl-、I-、SO42-中的4种,且溶液中各离子的物质的量浓度均为0.1mol·L-1。现取该溶液进行有关实验,实验结果如下图所示,下列有关说法正确的是

A. 该溶液中一定有上述离子中的NO3-、Al3+、SO42-、Cl-四种离子
B. 实物消耗Cu14.4g,则生成气体丁的体积为3.36L
C. 该溶液一定没有Fe3+,但是无法确定是否含有I-
D. 沉淀乙一定有BaCO3,可能有BaSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 mol/L NaOH溶液,有关粒子的物质的量变化如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。下列说法正确的是

A. M点溶液中:2c(HA-)+c(A2-)=0.2 mol/L
B. N点溶液呈酸性,则c(Na+) < 3c(HA-)
C. 若N点溶液pH =4.2,则Ka2(H2A)的数量级为104
D. V(NaOH)=20mL时,溶液中:c(H+) < c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com