
【题目】水芹烯是一种具有祛痰、抗菌、杀虫作用的添加剂,由水芹烯合成聚合物H的路线如图所示。
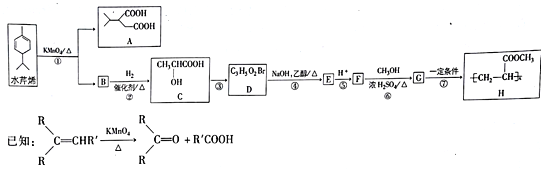
回答下列问题:
(1)水芹烯的分子式为_______ ,C的系统命名为_________________,反应④的反应类型为____。
(2)D分子中的官能团为(写名称)_______________,B的结构简式为___________ 。
(3)反应⑥的化学反应方程式为___________________________________。H在NaOH水溶液中发生水解反应的化学方程式为________________________________________。
(4)M是G的同分异构体,且能与NaHCO3反应生成CO2,则M的可能结构有________种(考虑立体异构)
(5)乙酸异丙酯CH3COOCH(CH3)2是重要的有机化工中间体,写出以2-甲基-2-丁烯为原料(其他无机试剂任选)制备乙酸异丙酯的合成路线_________。
【答案】C10H16 2-羟基丙酸 消去反应 羧基、溴原子 ![]() CH2=CHCOOH+CH3OH
CH2=CHCOOH+CH3OH![]() CH2=CHCOOCH3+H2O
CH2=CHCOOCH3+H2O ![]() +nNaOH
+nNaOH![]()
 + nCH3OH 5
+ nCH3OH 5 

【解析】
本题是有机推断题。在有机反应中无论反应物和产物如何变化,但涉及到的基本反应类型不会变,所以掌握有机反应的几个基本反应类型是解答有机推断题型的关键。①还原反应:有机物化合物分子中加氢或去氧的反应,烯、炔、苯、醛、酮、酚、油脂等都可以催化加氢。
②消去反应:在一定条件下,有机物脱去小分子生成分子中含有双键或三键的不饱和有机物的反应是消去反应。
③加成聚合反应:小分子的烯烃或烯烃的取代衍生物在加热和催化剂作用下,通过加成结合成高分子化合物的反应。
④酯化反应:一定条件下酸和醇生成酯和水的反应。
根据已知:
![]() ,可以推出B为
,可以推出B为![]() ,根据D的分子式分析可知D为C的羟基被溴原子取代的产物,则D为CH3CHBrCOOH,CH3CHBrCOOH在氢氧化钠的乙醇溶液中加热发生消去反应生成E为CH2=CHCOONa,E酸化后得到F为CH2=CHCOOH,F与甲醇在浓硫酸催化下发生酯化反应生成G为CH2=CHCOOCH3,G在一定条件下发生加聚反应生成H
,根据D的分子式分析可知D为C的羟基被溴原子取代的产物,则D为CH3CHBrCOOH,CH3CHBrCOOH在氢氧化钠的乙醇溶液中加热发生消去反应生成E为CH2=CHCOONa,E酸化后得到F为CH2=CHCOOH,F与甲醇在浓硫酸催化下发生酯化反应生成G为CH2=CHCOOCH3,G在一定条件下发生加聚反应生成H![]() 。
。
(1)水芹烯的分子式为C10H16;根据有机物系统命名法,C的系统命名为2-羟基丙酸;根据上述分析反应④的反应类型为消去反应。本小题答案为:C10H16;2-羟基丙酸;消去反应。
(2)根据上述分析D的结构简式为CH3CHBrCOOH,则D的官能团为羧基、溴原子;B的结构简式为![]() 。本小题答案为:羧基、溴原子;
。本小题答案为:羧基、溴原子;![]() 。
。
(3)根据上述分析F为CH2=CHCOOH,F与甲醇在浓硫酸催化下发生酯化反应生成G为CH2=CHCOOCH3,则反应⑥的化学反应方程式为CH2=CHCOOH+CH3OH![]() CH2=CHCOOCH3+H2O;H在NaOH水溶液中发生水解反应的化学方程式为
CH2=CHCOOCH3+H2O;H在NaOH水溶液中发生水解反应的化学方程式为![]() +nNaOH
+nNaOH![]()
 + nCH3OH。本小题答案为:CH2=CHCOOH+CH3OH
+ nCH3OH。本小题答案为:CH2=CHCOOH+CH3OH![]() CH2=CHCOOCH3+H2O;
CH2=CHCOOCH3+H2O;![]() +nNaOH
+nNaOH![]()
 + nCH3OH。
+ nCH3OH。
(4)M是G的同分异构体,且能与NaHCO3反应生成CO2,则M中含有羧基,可能的结构有CH3CH=CHCOOH、CH2=CHCH2COOH、CH2=C(CH3)COOH(有顺反2种异构)、![]() 共5种。本小题答案为:5。
共5种。本小题答案为:5。
(5)2-甲基-2-丁烯被高锰酸钾溶液氧化得到丙酮和乙酸,丙酮与氢气发生加成反应生成2-丙醇,2-丙醇与乙酸在浓硫酸催化下发生酯化反应生成![]() ,故合成路线
,故合成路线
为:
 。本小题答案为:
。本小题答案为:
 。
。


科目:高中化学 来源: 题型:
【题目】某氯化亚铁和氯化铁的混合物,现要测定其中FeCl2和FeCl3的物质的量,按以下步骤进行实验:
(1)将混合物配制成250mL的待测溶液,所用到的玻璃仪器除烧杯、胶头滴管、玻璃棒外,还必须有_______(填仪器名称)。
(2)取25.00mL待测溶液,向其中通入标准状况下336mLCl2恰好将Fe2+氧化为Fe3+,请写出通入氯气发生的反应的离子方程式:_______________;由此可知原溶液中n(FeCl2)=___________mol。
(3)向(2)反应后所得到溶液中加入过量的NaOH溶液,然后进行过滤,将所得沉淀洗涤干净,加热、灼烧该沉淀,冷却至室温后,准确称量可知,得到红棕色固体粉末3.2g,由此可以确定原溶液中c(FeCl3)=________mol·L—1 。
(4)检验Fe3+中含有Fe2+ 的方法是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一):意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子。N4分子结构如图所示,已知断裂1 mol N—N键吸收167 kJ热量,生成1 mol N≡N键放出942 kJ热量。根据以上信息和数据,则1 mol N4生成N2的 ΔH=______________

(二):50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是____________________。
(2)烧杯间填满碎纸条的作用是__________________________________________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值_________________(填“偏大”、“偏小”或“无影响”)。
(4)实验中60 mL0.50 mol/L盐酸与50 mL0.55 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量__________(填“相等”或“不相等”),所求中和热_________(填“相等”或“不相等”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为周期表的一部分,其中的编号代表对应的元素。

请回答下列问题:
(1)表中属于d区的元素是________(元素符号)。
(2)写出元素溴的基态原子的简化电子排布式_____________________,写出⑩的价电子排布图_____________________________________。
(3)某元素⑦的原子核外最外层电子的成对电子为________对。
(4)元素④的氢化物的分子构型为________,中心原子的杂化形式为________。
(5)第三周期8种元素按单质熔点高低的顺序如下图,其中序号“⑧”为________(填元素符号);其中电负性最大的是________(填元素符号)。

(6)⑩的基态原子有____种能量不同的电子;如图___(填“甲”、“乙”或“丙”)表示的是⑩晶体中微粒的堆积方式。晶体中距离一个⑩原子最近的⑩原子有____个。若该晶体中一个晶胞的边长为a pm,则⑩晶体的密度为__________g.cm-3(写出含a的表达式,用NA表示阿伏加德罗常数的值,不需化简)。若⑩的原子半径为r,则⑩晶胞这种堆积模型的空间利用率为__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国明代《本草纲目》记载了烧酒的制造工艺:“凡酸坏之酒,皆可蒸烧”,“以烧酒复烧二次价值倍也”。这里用到的实验方法可用于分离
A. CCl4和水 B. 酒精和水 C. 食盐水和泥沙 D. 硝酸钾和硫酸钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】皂化反应实验的操作步骤如下:
①在小烧杯中加入约5 g 新鲜的动物脂肪(如牛油)和6 mL 95%的乙醇,微热使脂肪完全溶解;
②在①的混合液中加入6 mL 40%的氢氧化钠溶液,边搅拌边加热,直至反应液变成黄棕色黏稠状;
③用玻璃棒蘸取反应液,滴入装有热水的试管中,振荡,若无油滴浮在液面上,说明反应液中油脂已完全反应,否则要继续加热使之反应完全;
④在另一只烧杯中加入60 mL 热的饱和食盐水,把得到的反应液倒入食盐水中,搅拌,观察浮在液面上的固体物质,取出,用滤纸或纱布吸干,挤压成块,并与日常使用的肥皂比较去污能力的大小。
根据上面的实验步骤,请回答下列问题:
(1)加入乙醇的原因是_______________________________________。
(2)请写出硬脂酸甘油酯发生皂化反应的化学方程式:__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知α氨基酸在一定条件下能与亚硝酸(HNO2)反应得到α羟基酸。如:![]() +N2↑+H2O,试根据下图所示关系回答下列有关问题。
+N2↑+H2O,试根据下图所示关系回答下列有关问题。

(1)写出A、B的结构简式:
A________________________________________________________________________;
B________________________________________________________________________。
(2)写出C→D的化学方程式:________________________________________。
(3)写出C→E的化学方程式:___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数之和为46,它们在周期表中的相对位置如图所示。下列说法正确的是
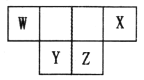
A. 原子半径大小顺序为:Y>Z>X
B. X元素最高价氧化物的水化物酸性最强
C. Y元素的简单氢化物稳定性最强
D. Z单质难溶于化合物WZ2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有Ⅰ、Ⅱ、Ⅲ3个体积均为0.5L的恒容密闭容器,在Ⅰ、Ⅱ、Ⅲ中按不同投料比(Z)充入HCl和O2(如下表),加入催化剂发生反应:4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g)△H。HCl的平衡转化率与Z和T的关系如图所示。
2Cl2(g)+2H2O(g)△H。HCl的平衡转化率与Z和T的关系如图所示。
容器 | 起始时 | ||
T/℃ | n(HCl)/mol | Z | |
Ⅰ | 300 | 0.25 | a |
Ⅱ | 300 | 0.25 | b |
Ⅲ | 300 | 0.25 | 4 |

下列说法不正确的是( )
A. △H<0
B. a<4<b
C. 若容器Ⅲ反应某时刻处于R点,则R点的反应速率:v(正)>v(逆)
D. 300℃时,该反应平衡常数的值为320
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com