


分析 【实验一】根据菠菜含有丰富的铁、草酸盐、碳酸盐等,用开水煮沸菠菜样品碎末2~3min,充分浸出可溶物,足量的CaCl2溶液可与菠菜中的草酸根离子及碳酸根离子充分反应,生成白色沉淀A为草酸钙和碳酸钙的混合物;根据所给资料可知:醋酸不与草酸钙反应,但能与碳酸钙反应生成可溶性盐,故白色沉淀B为草酸钙
(1)用开水煮沸菠菜样品碎末2~3min的目的是加快可溶物的溶解;
(2)溶液M为草酸盐和碳酸盐;
(3)C能使澄清石灰水变浑浊为二氧化碳,A与醋酸生成C的反应是醋酸和碳酸钙反应生成草酸钙、水和二氧化碳;
(4)分析可知B为:草酸钙;
(5)草酸是二元羧酸酸性强于碳酸;
【实验二】(3)①根据固体质量-分解温度的关系图象可知,800℃醋酸根完全分解生成氧化钙;
②200℃~400℃时,草酸钙并没有分解,400℃时草酸钙分解生成碳酸钙和一氧化碳,其质量由12.8g变为10.0g,据此写出反应的化学方程式;
③0~200℃时是晶体失去结晶水的过程,14.6克CaC2O4•xH2O失去水后生成12.8克CaC2O4,根据醋酸钙晶体分解关系式计算出x.
解答 解:【实验一】根据菠菜含有丰富的铁、草酸盐、碳酸盐等,用开水煮沸菠菜样品碎末2~3min,充分浸出可溶物,足量的CaCl2溶液可与菠菜中的草酸根离子及碳酸根离子充分反应,生成白色沉淀A为草酸钙和碳酸钙的混合物;根据所给资料可知:醋酸不与草酸钙反应,但能与碳酸钙反应生成可溶性盐,故白色沉淀B为草酸钙,
(1)用开水煮沸菠菜样品碎末2~3min的目的是充分浸出可溶物,
故答案为:充分浸出可溶物;
(2)液M中含有的主要阴离子有草酸盐和碳酸盐,含有的主要阴离子有C2O42-、CO32-,
故答案为:C2O42-、CO32-;
(3)C能使澄清石灰水变浑浊为二氧化碳,A与醋酸生成C的反应是醋酸和碳酸钙反应生成草酸钙、水和二氧化碳,反应的化学方程式为:2CH3COOH+CaCO3═(CH3COO)2Ca+CO2↑+H2O,
故答案为:2CH3COOH+CaCO3═(CH3COO)2Ca+CO2↑+H2O;
(4)生成白色沉淀A为草酸钙和碳酸钙的混合物;根据所给资料可知:醋酸不与草酸钙反应,但能与碳酸钙反应生成可溶性盐,故白色沉淀B为草酸钙,
故答案为:CaC2O4 ;
(5)草酸为羧酸类中的二元羧酸,草酸比碳酸的酸性强,
故答案为:强;
【实验二】(3)①根据图象可知600℃时发生碳酸钙分解反应,800℃时分解完全,则800℃以上时,固体成分为氧化钙,
故答案为:CaO;
②根据图象可知200℃~400℃,草酸钙并没有分解,400℃时草酸钙分解,其质量由12.8g变为10.0g,生成碳酸钙和CO,反应的化学方程式为CaC2O4$\frac{\underline{\;高温\;}}{\;}$CaCO3+CO↑,
故答案为:CaC2O4$\frac{\underline{\;高温\;}}{\;}$CaCO3+CO↑;
③根据图象可知0~200℃是晶体失去结晶水的过程,14.6克CaC2O4•xH2O失去水后生成12.8克CaC2O4,则
CaC2O4•xH2O~CaC2O4,
128+18x 128
14.6 12.8
解得x=1,
故答案为:1.
点评 本题通过实验的方式探究了菠菜不能与豆腐同食的原因,题目难度中等,属于应用化学知识解决生活中的实际问题的考查方式,完成此类题目应熟练掌握常见物质的性质,本题培养了学生对图象的分析应用能力.


科目:高中化学 来源: 题型:选择题
| A. | A与C可形成共价化合物 | |
| B. | A的氢化物的稳定性大于C的氢化物的稳定性 | |
| C. | A、C的最高价氧化物形成的晶体类型相同 | |
| D. | B的氧化物的熔点比A的氧化物熔点高 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,此化合物类型离子化合物(填“离子化合物”或“共价化合物”).
,此化合物类型离子化合物(填“离子化合物”或“共价化合物”).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
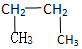
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中可能大量存在:Al3+、NH4+、Cl-、S2- | |
| B. | 0.1 mol/LFeCl3溶液中大量存在:Fe2+、NH4+、SCN-、SO42- | |
| C. | 加入Al粉产生H2的溶液中可能大量存在:K+、Na+、NO3-、Cl- | |
| D. | 中性溶液中可能大量存在:Fe3+、K+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该充电电池的阳极为Ni(OH)2 | |
| B. | 放电时,负极发生了氧化反应,反应为Cd+2OH--2e-═Cd(OH)2 | |
| C. | 充电时,阳极反应为Ni(OH)2(s)+OH-(aq)═NiOOH(s)+H2O(I)+e- | |
| D. | 电池工作时,负极区pH增大,正极区pH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 均能用CnH2n+2组成通式来表示 | |
| B. | 与所有烷烃互为同素异形体 | |
| C. | 因为它们的结构相似,所以它们的化学性质相似,物理性质相同 | |
| D. | 通常状况下,它们都是气态烷烃 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com