
下列常见金属的冶炼原理中不合理的是( )
|
|
金属 |
冶炼原理 |
|
A |
Fe |
Fe2O3+3CO2Fe+3CO2 |
|
B |
Hg |
2HgO2Hg+O2↑ |
|
C |
Mg |
2MgO(熔融)2Mg+O2↑ |
|
D |
Na |
2NaCl(熔融)2Na+Cl2↑ |
科目:高中化学 来源: 题型:阅读理解
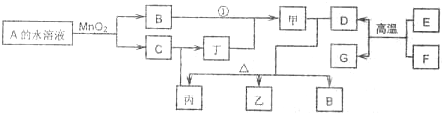
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 有关元素X、Y、Z、D、E的信息如下
有关元素X、Y、Z、D、E的信息如下| 元素 | 有关信息 |
| X | 元素主要化合价为-2,原子半径为0.074nm |
| Y | 所有主族序数与所在周期序数之差为4 |
| Z | 原子半径为0.102nm,其单质在X的单质中燃烧,发出明亮的蓝紫色火焰 |
| D | 最高价氧化物既能溶于强酸又能溶于强碱 |
| E | 单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏 |


| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
有关元素A、B、C、D、E的信息如下:
| 元素 | 有关信息 |
| A | 元素主要化合价为-2,A的一种氢化物可用于实验室制取A的单质 |
| B | 所在主族序数与所在周期序数之差为4 |
| C | 原子中含10个P电子 |
| D | 最高价氧化物对应的水化物,能电离出电子数相等的阴、阳离子 |
| E | 生活中常见金属,它有两种氯化物,相对原子质量相差35.5 |
请回答下列问题:
 (1)元素A~E中两种元素组成的化合物使品红溶液褪色的物质的化学式为______。
(1)元素A~E中两种元素组成的化合物使品红溶液褪色的物质的化学式为______。
(2)E元素与B元素可形成EB2和EB3两种化合物,下列说法正确的是(填序号)________。
①保存EB2溶液时,需向溶液中加入少量E单质
②EB2只能通过置换反应生成,EB3只能通过化合反应生成
③铜片、碳棒和EB3溶液组成原电池,电子由铜片沿导线流向碳棒
④向淀粉碘化钾溶液和苯酚溶液中分别滴加几滴EY3的浓溶液,原无色溶液都变为紫色
(3)用化学符号表示D2C的水溶液中各粒子的浓度关系,如c(C2-)=______________。
(4)将一定量的B单质通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中含有三种含B元素的离子,其中两种离子的物质的量(n)与反应时间(t)的变化示意图如下图所示。该苛性钾溶液中KOH的质量是___________,该反应中转移电子的物质的量是_________。
(5)工业上冶炼E单质的化学方程式为__________________________________。
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素 | 有关信息 |
| X | 元素主要化合价为-2,原子半径为0.074nm |
| Y | 所有主族序数与所在周期序数之差为4 |
| Z | 原子半径为0.102nm,其单质在X的单质中燃烧,发出明亮的蓝紫色火焰 |
| D | 最高价氧化物既能溶于强酸又能溶于强碱 |
| E | 单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏 |

查看答案和解析>>
科目:高中化学 来源:2011年天津市和平区耀华中学高考化学一模试卷(解析版) 题型:填空题
| 元素 | 有关信息 |
| X | 元素主要化合价为-2,原子半径为0.074nm |
| Y | 所有主族序数与所在周期序数之差为4 |
| Z | 原子半径为0.102nm,其单质在X的单质中燃烧,发出明亮的蓝紫色火焰 |
| D | 最高价氧化物既能溶于强酸又能溶于强碱 |
| E | 单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com