
【题目】为了使宇航员在飞船中得到一个稳定的、良好的生存环境,一般在飞船内安装盛有Na2O2或K2O2颗粒的装置,它的用途是产生氧气。下列关于Na2O2的叙述正确的是
①Na2O2中阴、阳离子的个数比是1∶1
②Na2O2分别与水及CO2反应产生等量氧气时,需水和CO2的质量相等
③Na2O2分别与水及CO2反应产生等量氧气时,转移电子的物质的量相等
④Na2O2的漂白原理与SO2的漂白原理相同
⑤Na2O2与SO2反应生成Na2SO3与O2
⑥Na2O2能与酸反应生成盐和水,所以Na2O2是碱性氧化物
⑦Na2O2与水反应,Na2O2既是氧化剂,又是还原剂
⑧Na2O2投入到紫色石蕊溶液中,溶液先变蓝,后褪色
A.①③⑥⑧B.③⑦⑧
C.②⑤⑥⑦D.①④⑧
【答案】B
【解析】
①Na2O2中有1个O22-和2个Na+,阴、阳离子个数比为1:2,①错误;
②![]() ,
,![]()
![]() ,产生等量氧气,需要
,产生等量氧气,需要![]() 和
和![]() 的物质的量相等,但由于摩尔质量不等,故质量不等,②错误;
的物质的量相等,但由于摩尔质量不等,故质量不等,②错误;
③每产生![]() 转移电子为
转移电子为![]() ,产生氧气的量相等,转移电子相等,③正确;
,产生氧气的量相等,转移电子相等,③正确;
④Na2O2漂白是利用其强氧化性,而SO2漂白是由于结合有色物质生成了不稳定的无色物质,原理不相同,④错误;
⑤Na2O2具有强氧化性,能氧化SO2,![]() ,⑤错误;
,⑤错误;
⑥Na2O2能与酸反应生成盐、水和氧气,过氧化钠属于过氧化物,⑥错误;
⑦![]() ,Na2O2中氧的化合价既升高又降低,Na2O2既是氧化剂,又是还原剂,⑦正确;
,Na2O2中氧的化合价既升高又降低,Na2O2既是氧化剂,又是还原剂,⑦正确;
⑧![]() ,溶液呈碱性,故变蓝,但由于Na2O2强氧化性,能漂白,故褪色,⑧正确;
,溶液呈碱性,故变蓝,但由于Na2O2强氧化性,能漂白,故褪色,⑧正确;
综上,正确的为③⑦⑧。
答案选B。


科目:高中化学 来源: 题型:
【题目】(1)在①CO2,②NaCl,③Na,④Si,⑤CS2,⑥金刚石,⑦(NH4)2SO4,⑧乙醇中,由极性键形成的非极性分子有_______(填序号,以下同),含有金属离子的物质是__,分子间可形成氢键的物质是________,属于离子晶体的是__,属于原子晶体的是__,①~⑤五种物质的熔点由高到低的顺序是__。
(2)A,B,C,D为四种晶体,性质如下:
A.固态时能导电,能溶于盐酸
B.能溶于CS2,不溶于水
C.固态时不导电,液态时能导电,可溶于水
D.固态、液态时均不导电,熔点为3500 ℃
试推断它们的晶体类型:A.__;B.__;C.__;D.__。
(3)下图中A~D是中学化学教科书上常见的几种晶体结构模型,请填写相应物质的名称:A.__;B.__;C.__D.____。
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是
A. 32 g S8(分子结构:![]() )中的共价键数目为NA
)中的共价键数目为NA
B. 2 g由H218O和2H2O组成的物质中含有的质子数为NA
C. 8 g CuO与足量H2充分反应生成Cu,该反应转移的电子数为0.2NA
D. 标准状况下,11.2 L Cl2溶于水,溶液中Cl-、ClO-和HClO的微粒数之和为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知强酸与强碱在稀溶液里反应的中和热可表示为:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ·mol-1对下列反应:
CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) ΔH=-Q1kJ·mol-1
![]() H2SO4(浓)+NaOH(aq)=
H2SO4(浓)+NaOH(aq)=![]() Na2SO4(aq)+H2O(l) ΔH=-Q2kJ·mol-1
Na2SO4(aq)+H2O(l) ΔH=-Q2kJ·mol-1
HNO3(aq)+NaOH(aq)=NaNO3(aq)+H2O(l) ΔH=-Q3kJ·mol-1
上述反应均在溶液中进行,则下列Q1、Q2、Q3的关系正确的是( )
A.Q2>Q3>Q1B.Q2>Q1>Q3C.Q1=Q2=Q3D.Q2=Q3>Q1
查看答案和解析>>
科目:高中化学 来源: 题型:
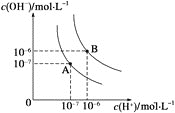
【题目】(1)水的电离平衡曲线如图所示,若A点表示25 ℃时水的电离达平衡时的离子浓度,B点表示100 ℃时水的电离达平衡时的离子浓度。则100 ℃时1 mol·L-1的NaOH溶液中,由水电离出的c(H+)________mol·L-1,Kw(25 ℃)________Kw(100 ℃)(填“>”、“<”或“=”)。25 ℃时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是________(填“促进”、“抑制”或“不影响”)。
(2)电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
化学式 | 电离平衡常数(25℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
①25 ℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三种溶液的pH由大到小的顺序为_____________________________。
②25 ℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,所得溶液显碱性,则c(Na+)______c(CH3COO-)(填“>”、“<”或“=”)。
③向NaCN溶液中通入少量CO2,所发生反应的化学方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室制备纯净氯气的实验装置,试回答下列问题:
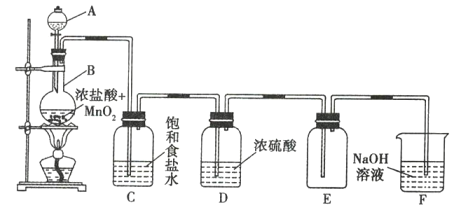
(1)写出下列仪器的名称:A __________________ ,B ________________ 。
(2)写出制备氯气的反应的离子方程式: __________________ 。
(3)装置C的作用是 __________________ ,装置D的作用是 __________________ 。
(4)装置F的作用是 __________________ (用化学方程式表示)。
(5)实验结束时,需要先撤去B与C之间的导管,然后再撤掉酒精灯。若先撤掉酒精灯,而不撤去B与C之间的导管,则会导致 __________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“大同”化学小组在实验室中对![]() 进行探究。回答下列问题:
进行探究。回答下列问题:
(1)![]() 学生甲用下图E装置制备
学生甲用下图E装置制备![]() 。主反应的发生,表明硫酸具有的性质有________
。主反应的发生,表明硫酸具有的性质有________

A.氧化性 ![]() 还原性
还原性 ![]() 酸性
酸性 ![]() 碱性
碱性
![]() 学生乙以
学生乙以![]() 粉未和
粉未和![]() 为原料制取
为原料制取![]() ,反应的化学方程式是:___
,反应的化学方程式是:___
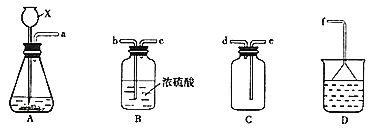
![]() 现欲收集一瓶干燥的
现欲收集一瓶干燥的![]() ,选用下图中的A、B、C、D装置,其连接顺序
,选用下图中的A、B、C、D装置,其连接顺序![]() 按气流方向,用小写字母表示,可重复选用
按气流方向,用小写字母表示,可重复选用![]() 为:_________
为:_________
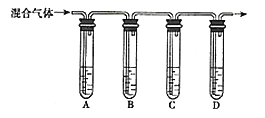
(2)学生丙用浓![]() 和蔗糖反应,得到的气体中含有
和蔗糖反应,得到的气体中含有![]() 、
、![]() 。现选择下图中的装置,验证混合气体中存在
。现选择下图中的装置,验证混合气体中存在![]() 和
和![]() 。其中,能证明存在
。其中,能证明存在![]() 的现象是_____。
的现象是_____。
(3)学生甲实验中,大试管内产生了大量黑色固体。查阅资料知:
![]() 黑色固体可能含有CuO、CuS、
黑色固体可能含有CuO、CuS、![]() 。
。
![]() 和
和![]() 不溶于稀盐酸、稀硫酸,但加热下可溶于稀硝酸。
不溶于稀盐酸、稀硫酸,但加热下可溶于稀硝酸。
![]() 向含微量
向含微量 ![]() 的溶液中滴加
的溶液中滴加![]() 溶液,能产生红褐色沉淀。
溶液,能产生红褐色沉淀。
现取少量黑色沉淀,加入稀硫酸,充分振荡以后,再滴加![]() 溶液,未见红褐色沉淀,由此所得结论是_____________________。另取少量黑色沉淀,加入足量稀硝酸并加热,发现黑色固体最终完全溶解,溶液变为蓝色,有无色气泡生成,管口处出现红棕色。试写出CuS溶于足量稀硝酸的离子方程式:__________为测定黑色沉淀中
溶液,未见红褐色沉淀,由此所得结论是_____________________。另取少量黑色沉淀,加入足量稀硝酸并加热,发现黑色固体最终完全溶解,溶液变为蓝色,有无色气泡生成,管口处出现红棕色。试写出CuS溶于足量稀硝酸的离子方程式:__________为测定黑色沉淀中![]() 的百分含量,取
的百分含量,取![]() 黑色沉淀,在酸性溶液中用
黑色沉淀,在酸性溶液中用 ![]() 溶液处理,发生反应如下:
溶液处理,发生反应如下:![]()
![]() ,反应后煮沸溶液,赶尽
,反应后煮沸溶液,赶尽![]() ,过量的高锰酸钾溶液恰好与
,过量的高锰酸钾溶液恰好与![]() 溶液完全反应。则混合物中
溶液完全反应。则混合物中![]() 的质量分数为 ___________
的质量分数为 ___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在一个体积可变的密闭容器中充入2 mol的气体A和1 mol的气体B发生反应:2A(g)+B(g)![]() 3C(g) ΔH>0。t1时刻反应达到平衡,并测得C在容器中的体积分数为φ1。t2时刻改变某一条件(其他条件不变),C在容器中的体积分数的变化如图所示,则t2时刻改变的条件是( )
3C(g) ΔH>0。t1时刻反应达到平衡,并测得C在容器中的体积分数为φ1。t2时刻改变某一条件(其他条件不变),C在容器中的体积分数的变化如图所示,则t2时刻改变的条件是( )

A. 加入1 mol氦气
B. 加入1 mol B
C. 增大压强
D. 升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值。下列说法正确的是
A.一定条件下,1molN2和3molH2充分反应,生成物中的N-H键数目为6NA
B.完全燃烧1.5molCH3CH2OH和C2H4的混合物,转移电子数为18NA
C.100g 98%的浓硫酸中含氧原子个数为4NA
D.1L 0.1 mol/L的Na2S溶液中S2-和HS-的总数为0.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com