
【题目】4molL﹣1的KOH溶液100mL,取出5mL,这5mL溶液中K+浓度为
A.0.2molL﹣1 B.0.4 molL﹣1 C.2 molL﹣1D.4 molL﹣1
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案科目:高中化学 来源: 题型:
【题目】某含苯环的化合物A,其相对分子质量为104,碳的质量分数为92.3%。
(1)A的分子式为____________。
(2)A与溴的四氯化碳溶液反应的化学方程式为____________,反应类型是____________。
(3)已知: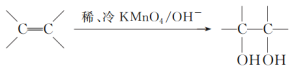 。请写出A与稀、冷的KMnO4溶液在碱性条件下反应的化学方程式___________。
。请写出A与稀、冷的KMnO4溶液在碱性条件下反应的化学方程式___________。
(4)一定条件下,A与氢气反应,得到的化合物中碳的质量分数为85.7%,写出此化合物的结构简式__________________。
(5)在一定条件下,由A聚合得到的高分子化合物的结构简式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利胆解痉药“亮菌甲素”跟(CH3)2SO4反应可以生成A,二者的结构简式如图. 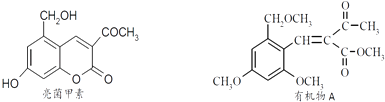
(1)“亮菌甲素”的分子式为: , 1mol“亮菌甲素”跟溴水反应时最多消耗mol Br2;能发生水解反应的官能团名称是 , 能发生还原反应的官能团名称是
(2)有机物A能发生如下转化,其中G分子中的碳原子在一条直线上. 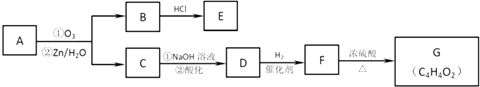
信息提示:i. ![]()
ii.R﹣O﹣CH3 ![]() R﹣OH(R为脂肪烃或芳香烃基)
R﹣OH(R为脂肪烃或芳香烃基)
①B→E的化学方程式是: .
②G的结构简式是: .
③H是G的一种同分异构体,可以发生水解反应,写出其结构简式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。关于该电池的叙述正确的是( )
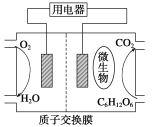
A.该电池能够在高温下工作
B.电池的负极反应式为C6H12O6+6H2O-24e-===6CO2↑+24H+
C.放电过程中,H+从正极区向负极区迁移
D.在电池反应中,每消耗1 mol氧气,理论上能生成标准状况下CO2气体![]() L
L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由锌片、铜片和200 mL稀H2SO4组成的原电池如图所示。
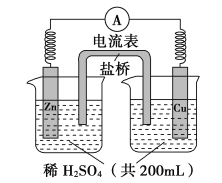
(1)原电池的负极反应是______________________,
正极反应是__________________________。
(2)电流的方向是_____________。
(3)一段时间后,当在铜片上放出1.68 L(标准状况下)气体时,H2SO4恰好消耗一半。则产生这些气体的同时,共消耗________g锌,有____________个电子通过了导线,原硫酸的物质的量浓度是_____________(设溶液体积不变)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,我国拥有完全自主产权的氢氧燃料电池车将在北京奥运会期间为运动员提供服务。某种氢氧燃料电池的电解质溶液为KOH溶液。下列有关该电池的叙述不正确的是
A. 正极反应式为:O2+2H2O+4e-=4OH-
B. 工作一段时间后,电解质溶液中KOH的物质的量不变
C. 该燃料电池的总反应方程式为:2H2+O2=2H2O
D. 用该电池电解CuCl2溶液,产生2.24 L Cl2(标准状况)时,有0.1 mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组拟制备氯气并验证其一系列性质,实验装置如图所示(省略夹持装置).已知:硫代硫酸钠(Na2S2O3)溶液在工业上可作为脱氯剂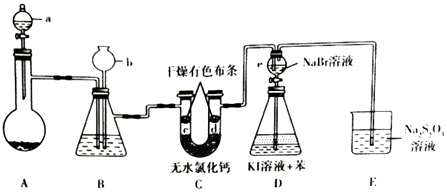
回答下列问题:
(1)仪器a的名称是 , 其中盛有浓盐酸,烧瓶A 中盛有的固体试剂是(填化学式).
(2)装置B中盛有饱和NaCl溶液,装置B的作用是 .
a.除去C12中的杂质HCl b.干燥 c.提供后续水蒸气 d.观察装置是否堵塞
(3)c处有色布条褪色,而d处不褪色,这说明 .
(4)实验结束后,打开e 的活塞,使其中的溶液流人到锥形瓶D中,摇匀锥形瓶,静置后可观察到
(5)装置E中发生反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度下,在体积相等的三个恒容器闭容器中发生可逆反应:2NH3(g)![]() N2(g)+3H3(g) ΔH=+92.4 kJ/mol。
N2(g)+3H3(g) ΔH=+92.4 kJ/mol。
实验测得起始、平衡时的有关数据如下表:
容器 编号 | 起始时各物质物质的量/mol | 平衡时反应中 的能量变化 | ||
NH3 | N2 | H2 | ||
① | 2 | 0 | 0 | 吸收热量a kJ |
② | 0 | 1 | 3 | 放出热量b kJ |
③ | 4 | 0 | 0 | 吸收热量c kJ |
下列叙述正确的是( )
A.热量关系:a=b
B.①②③反应的平衡常数:③>①>②
C.达平衡时H2的体积分数:①>③
D.①中的密度不再改变时说明反应已达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以炼锌厂的烟道灰(主要成分为ZnO,另含少量Fe2O3、CuO、SiO2、MnO等)为原料可生产草酸锌晶体(ZnC2O42H2O). 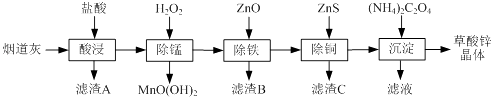
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 4.2 | 5.4 |
沉淀完全的pH | 3.3 | 9.7 | 6.7 | 8.2 |
请问答下列问题:
(1)滤渣A的主要成分为 .
(2)除锰过程中产生MnO(OH)2沉淀的离子方程式为 .
(3)①除铁(部分Cu2+可能被除去)时加入ZnO控制反应液pH的范围为 . ②上述流程中除铁与除铜的顺序不能颠倒,否则除铁率会减小,其原因是 .
(4)若沉淀过程采用Na2C2O4代替(NH4)2C2O4生产草酸锌晶体,合理的加料方式是 .
(5)将草酸锌晶体加热分解可得到一种纳米材料.加热过程中固体残留率随温度的变化如下图所示,300℃~460℃范围内,发生反应的化学方程式为 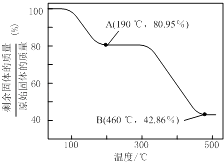
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com