
【题目】2019年诺贝尔化学奖授予了锂离子电池开发的三位科学家,一种高能LiFePO4电池多应用于公共交通,结构如图所示。电池中间是聚合物的隔膜,其主要作用是在反应过程中只让Li+通过,原理如下:(1-x)LiFePO4+xFePO4+LixCn![]() LiFePO4+nC。下列说法错误的是
LiFePO4+nC。下列说法错误的是
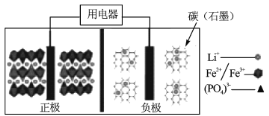
A.放电时,Li+向正极移动
B.放电时,电子由负极→用电器→正极
C.充电时,阴极反应为xLi++nC+xe-=LixCn
D.充电时,当溶液中通过1 mol e-时,阳极质量减小7g
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】有关![]() 分子结构的下列叙述中正确的是
分子结构的下列叙述中正确的是
①除苯环外的其余碳原子有可能都在一条直线上
②除苯环外的其余碳原子不可能都在一条直线上
③12个碳原子不可能都在同一平面上
④12个碳原子有可能都在同一平面上
A. ①② B. ②③ C. ①③ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
A.1L0.lmol/L的Na2SiO3溶液中含阴离子总数为0.1NA个
B.0.1mol的2H37Cl分子的中子数是2.1NA
C.7.8gNa2O2与足量水充分反应转移的电子数目为0.2NA
D.1mol雄黄(As4S4),结构如图:![]() ,含有4NA个S-S键
,含有4NA个S-S键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第四周期某些过渡元素在工业生产中有着极其重要的作用。
(1)铬是最硬的金属单质,被称为“不锈钢的添加剂”。写出Cr在周期表中的位置___;其原子核外电子排布的最高能层符号为___。
(2)在1molCrO5(其中Cr为+6价)中,含有过氧键的数目为__。
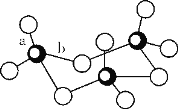
(3)钒(23V)广泛用于催化及钢铁工业,被称之为“工业的味精”。写出钒原子价电子排布图___;V2O5常用作SO2转化为SO3的催化剂。SO3的三聚体环状结构如图所示,该结构中S原子的杂化轨道类型为___。
(4)Ni是一种优良的有机反应催化剂,Ni能与CO形成正四面体形的配合物Ni(CO)4,其中配原子是____。(填元素符号)
(5)钛称之为21世纪金属,具有一定的生物功能。钙钛矿(CaTiO3)晶体是工业获取钛的重要原料。CaTiO3晶胞如图,边长为a=0.266nm,晶胞中Ti、Ca、O分别处于顶角、体心、面心位置。Ti与O间的最短距离为___nm,与Ti紧邻的O个数为___。
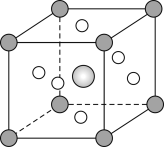
(6)在CaTiO3晶胞结构的另一种表示中,Ca处于各顶角位置,则Ti处于___位置,O处于___位置。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在以下各种情形下,下列电离方程式的书写正确的是
A.熔融状态下的NaHSO4电离:NaHSO4=Na++H++SO42-
B.H2CO3的电离:H2CO3![]() 2H++CO32-
2H++CO32-
C.Fe(OH)3的电离:Fe(OH)3![]() Fe3++3OH-
Fe3++3OH-
D.水溶液中的NaHSO4电离:NaHSO4=Na++HSO4-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关水的电离平衡的说法正确的是( )
A.水的离子积通常用![]() 来表示,只适用于纯水,在稀盐酸中数值会变大
来表示,只适用于纯水,在稀盐酸中数值会变大
B.在纯水中加入硫酸会抑制水的电离,加醋酸会促进水的电离
C.盐溶于水对水的电离平衡均没有影响,水溶液一定呈中性
D.在纯水中加入氢氧化铁固体对水的电离平衡会有微弱的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.贮氢合金ThNi5可催化由CO、H2合成CH4等有机化工产品的反应。温度为TK时发生以下反应:2CO(g)+O2(g)=2CO2(g) △H=-566 kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H=-571.6 kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890 kJ·mol-1
(1)温度为TK时,催化由CO、H2合成CH4反应的热化学方程式为___________。
(2)已知温度为TK时CH4(g)+2H2O(g)=CO2(g)+4H2(g) △H=+165 kJ·mol-1的活化能为485.2kJ/mol,则其逆反应的活化能为________kJ/mol。
II.对于反应CO(g)+H2O(g)CO2(g)+H2(g) △H=-41 kJ·mol-1进行以下研究:
(3)TK时,向一恒压密闭容器中充入等物质的量的CO(g)和H2O(g)发生上述反应,测得CO(g)物质的量分数随时间变化如下表所示:
时间/min | 0 | 2 | 5 | 6 | 9 | 10 |
x(CO) | 0.5 | 0.25 | 0.1 | 0.1 | 0.05 | 0.05 |
若初始投入CO为2 mol,恒压容器容积10 L,用H2O(g)表示该反应0~5分钟内的速率υ(H2O(g)=_____,6分钟时,仅改变一种条件破坏了平衡,则改变的外界条件为___________。
(4)已知700K时,在恒容密闭容器中,充入等物质的量的CO和H2O(g),发生上述反应,平衡CO体积分数为![]() ,则反应的平衡常数K=______。
,则反应的平衡常数K=______。
(5)在400K、500K时进行上述反应,其中CO和H2的分压随时间变化关系如右图所示,催化剂为氧化铁。实验初始时体系中的p(H2O)和p(CO)相等、p(CO2)和p(H2)相等。

400K时p(H2)随时间变化关系的曲线是______,500K时p(CO)随时间变化关系的曲线是_______。(填字母序号)
III.在催化剂的作用下发生反应CO(g)+2H2(g)![]() CH3OH(g),是合成甲醇的一种方法。
CH3OH(g),是合成甲醇的一种方法。
(6)某温度下,将2 mol CO与5 mol H2的混合气体充入容积为2 L的密闭容器中,在催化剂的作用下发生反应CO(g)+2H2(g)![]() CH3OH(g)。经过5 min后,反应达到平衡,此时转移电子6 mol。若保持体积不变,再充入2 mol CO和1.5 mol CH3OH,此时υ(正)_______υ(逆)(填“>”“<”或“=”)。下列不能说明该反应已达到平衡状态的是___________。
CH3OH(g)。经过5 min后,反应达到平衡,此时转移电子6 mol。若保持体积不变,再充入2 mol CO和1.5 mol CH3OH,此时υ(正)_______υ(逆)(填“>”“<”或“=”)。下列不能说明该反应已达到平衡状态的是___________。
a.CH3OH的质量不变 b.混合气体的平均相对分子质量不再改变 c.υ(逆)(CO)=2υ(正)(H2) d.混合气体的密度不再发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于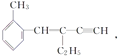 ,下列结论正确的是( )
,下列结论正确的是( )
A. 该有机物分子式为C13H16 B. 该有机物属于苯的同系物
C. 该有机物分子至少有4个碳原子共直线 D. 该有机物分子最多有13个碳原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于酸碱中和滴定实验的说法正确的是( )

A.用图B的滴定管可准确量取25.00mL的酸性KMnO4溶液
B.滴定过程中,眼睛要时刻注视滴定管中液面的变化
C.滴定管装入液体前需用待装液润洗
D.滴定前平视,滴定结束后仰视读数,不影响测定结果
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com