
| A. | 可用氧化物形式表示为BaO•CuO•2SiO2 | |
| B. | 性质稳定,不易脱色 | |
| C. | 易溶解于强酸和强碱 | |
| D. | x等于6 |
分析 A.根据矿物质用氧化物的形式表示时书写顺序是:活泼金属氧化物、较不活泼金属氧化物、二氧化硅、水来分析;
B.硅酸盐性质稳定;
C.硅酸盐能和强酸反应;
D.硅酸铜钡的化学式为BaCuSi2OX,利用钡、铜、硅、氧元素的化合价及化合物中正负化合价的代数和为0来解答.
解答 解:A.硅酸盐用氧化物形式表示时,书写顺序为:活泼金属氧化物、较不活泼金属氧化物、二氧化硅、水,所以硅酸铜钡用氧化物形式表示:BaO•CuO•2SiO2,故A正确;
B.BaCuSi2O6中铜显+2价,二价铜离子不容易被还原,所以性质较稳定,不容易褪色,故B正确;
C.BaCuSi2O6是弱酸盐,所以能和强酸反应,和强碱不反应,故C错误;
D.在硅酸铜钡中的铜元素化合价为+2,硅元素化合价为+4,氧元素的化合价为-2价,钡元素的化合价为+2价,则由化学式为BaCuSi2OX,根据化合物中正负化合价的代数和为0可得:(+2)+(+2)+(+4)×2+(-2)×x=0,解得x=6,故D正确.
故选C.
点评 本题考查了硅酸盐的性质及利用化学式和元素的化合价来计算原子个数,难度不大,明确硅酸盐用氧化物形式表示时书写顺序,学生应利用信息中元素的化合价和常见元素在化合物中的化合价并结合化合价计算的原则来进行计算.


 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
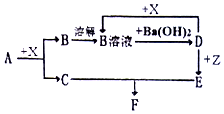 下列物质均为常见物质或它们的溶液,其中A为淡黄色固休,C、X均为无色气体,Z为浅绿色溶液,D为一种常见的强碱.根据它们之间的转化关系(如图),用化学用语回答问题.(部分产物已省略)
下列物质均为常见物质或它们的溶液,其中A为淡黄色固休,C、X均为无色气体,Z为浅绿色溶液,D为一种常见的强碱.根据它们之间的转化关系(如图),用化学用语回答问题.(部分产物已省略) .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向水中滴入少量稀盐酸,平衡逆向移动,Kw减小 | |
| B. | 将水加热,Kw增大,pH减小 | |
| C. | 向水中加入少量固体CH3COONa固体,平衡逆向移动,c(H+)降低 | |
| D. | 向水中加入少量固体硫酸钠,c(H+)和Kw均不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
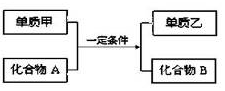
 ,在这个反应中作氧化剂的是H2O(填化学式)
,在这个反应中作氧化剂的是H2O(填化学式)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(SO42-)=c(HS-)=c(K+)>c(OH-)=c(H+) | |
| B. | c(Na+)>c(K+)>c(S2-)>c(H+)>c(OH-) | |
| C. | c(Na+)=c(S2-)+c(HS-)+c(H2S)+c(SO42-) | |
| D. | c(K+)+c(Na+)+c(H+)=c(SO42-)+c(S2-)+c(HS-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

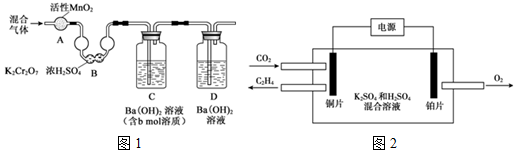
| 温度(℃) CO2 浓度 (mol/L) 时间(min) | 15 | 25 | 35 |
| 0 | 0 | 0 | 0 |
| t1 | 3×10-3 | 0.9×10-2 | 2.7×10-2 |
| t2 | 1×10-3 | 1.6×10-2 | 3.1×10-2 |
| t3 | 1×10-3 | 1.6×10-2 | 3.1×10-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com