
分析 (1)2L 1mol/L 的H2SO4 溶液,溶质的物质的量为:2L×1mol/L=2mol,1mol硫酸中含有2mol的氢离子,所以2mol硫酸中含氢离子的物质的量为4mol;
(2)根据反应的化学方程式结合过氧化钠的质量列比例式计算;
(3)设氢气的物质的量为xmol,氧气的物质的量为ymol,依据n=$\frac{m}{M}$=$\frac{V}{{V}_{m}}$,计算解答.
解答 解:(1)2L 1mol/L 的H2SO4 溶液,溶质的物质的量为:2L×1mol/L=2mol,1mol硫酸中含有2mol的氢离子,所以2mol硫酸中含氢离子的物质的量为4mol,个数为4NA,故答案为:2;4NA;
(2)2Na+2H2O═2NaOH+H2↑
46g 2mol 22.4L
2.3g n(NaOH) V(O2)
解得:n(NaOH)=$\frac{2.3g×2mol}{46g}$=0.1mol
V(H2)=$\frac{2.3g×22.4L}{46g}$=1.12L
故答案为:0.1;1.12L;
(3)设氢气的物质的量为xmol,氧气的物质的量为ymol则:2x+18y=36,(x+y)×22.4L/mol=6.72L,解得:x=2,y=1,
同温同压下,气体的体积之比等于物质的量之比所以这种混合气体中H2和O2的体积:2:1;
混合气体的平均摩尔质量M=$\frac{m}{M}$=$\frac{36g}{3mol}$=12g/mol.
故答案为:2:1;12g/mol.
点评 本题考查阿伏伽德罗定律及应用,为高频考点,把握以物质的量为核心的计算公式是解题关键,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| t/min | 1 | 2 | 3 | 4 |
| c(N2O5)/mol.L-1 | 0.133 | 0.080 | 0.057 | 0.040 |
| v正/mol.L-1.min-1 | 0.0466 | 0.028 | 0.020 | 0.014 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ①②③ | C. | ①②③⑤ | D. | 全部正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ⅰ、Ⅱ两途径最终达到平衡时,体系内混合气体的百分组成相同 | |
| B. | Ⅰ、Ⅱ两途径最终达到平衡时,体系内混合气体的百分组成不同 | |
| C. | 达平衡时,Ⅰ途径的反应速率v1等于Ⅱ途径的反应速率v2 | |
| D. | 达平衡时,Ⅰ途径混合气体的密度与Ⅱ途径混合气体的密度相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | OH-、H2O、F- | B. | NH3、NH4+、NH2- | C. | H3O+、NH4+、NH2- | D. | HCl、F2、H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
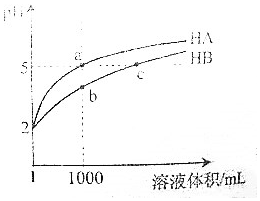 25℃时,pH=2的HA和HB各1mL分别加水稀释,pH随溶液体积变化如图所示.下列叙述正确的是( )
25℃时,pH=2的HA和HB各1mL分别加水稀释,pH随溶液体积变化如图所示.下列叙述正确的是( )| A. | Kw的数值:a点大于c点 | |
| B. | 溶液中的总酸量:a点大于b点 | |
| C. | HB的电离程度:b点大于c点 | |
| D. | 将a点与b点两溶液同时升高温度,则$\frac{c({A}^{-})}{c({B}^{-})}$减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com